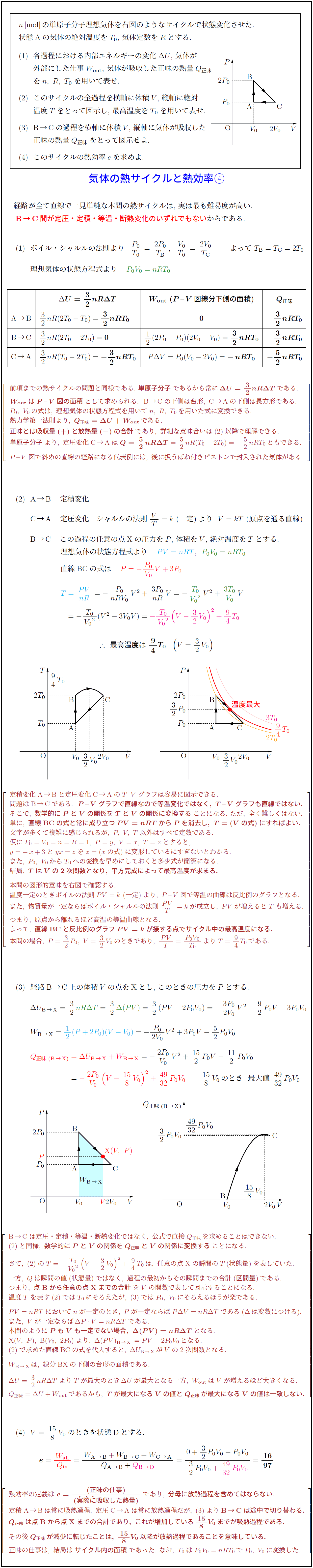
n [mol] の単原子分子理想気体を右図のようなサイクルで状態変化させた.
状態Aの気体の絶対温度を T₀, 気体定数を R とする.
(1) 各過程における内部エネルギーの変化 ΔU, 気体が
外部にした仕事 Wout, 気体が吸収した正味の熱量 Q正味
を n, R, T₀ を用いて表せ.
(2) このサイクルの全過程を横軸に体積 V, 縦軸に絶対
温度 T をとって図示し, 最高温度を T₀ を用いて表せ.
(3) B→C の過程を横軸に体積 V, 縦軸に気体が吸収した
正味の熱量 Q正味 をとって図示せよ.
(4) このサイクルの熱効率 e を求めよ.
気体の熱サイクルと熱効率④
経路が全て直線で一見単純な本問の熱サイクルは, 実は最も難易度が高い.
B→C 間が定圧・定積・等温・断熱変化のいずれでもないからである.
(1) ボイル・シャルルの法則より P₀/T₀ = 2P₀/TB, V₀/T₀ = 2V₀/TC よって TB = TC = 2T₀
理想気体の状態方程式より P₀V₀ = nRT₀
[以下、表の TeX をコマンド除去してそのまま文字列化]
| | ΔU = 3/2 nRΔT | Wout (P–V 図線分下側の面積) | Q正味 |
| A→B | 3/2 nR(2T₀−T₀) = 3/2 nRT₀ | 0 | 3/2 nRT₀ |
| B→C | 3/2 nR(2T₀−2T₀) = 0 | 1/2(2P₀+P₀)(2V₀−V₀) = 3/2 nRT₀ | 3/2 nRT₀ |
| C→A | 3/2 nR(T₀−2T₀) = −3/2 nRT₀ | PΔV = P₀(V₀−2V₀) = −nRT₀ | −5/2 nRT₀ |
[説明文]
前項までの熱サイクルの問題と同様である. 単原子分子であるから常に ΔU = 3/2 nRΔT である.
Wout は P–V 図の面積として求められる. B→C の下側は台形, C→A の下側は長方形である.
P₀, V₀ の式は, 理想気体の状態方程式を用いて n, R, T₀ を用いた式に変換できる.
熱力学第一法則より, Q正味 = ΔU + Wout である.
正味とは吸収量(+) と放熱量(−) の合計であり, 詳細な意味合いは (2) 以降で理解できる.
単原子分子より, 定圧変化 C→A は Q = 5/2 nRΔT = 5/2 nR(T₀−2T₀) = −5/2 nRT₀ ともできる.
P–V 図で斜めの直線の経路になる代表例には, 後に扱うばね付きピストンで封入された気体がある.
A→B 定積変化
C→A 定圧変化 シャルルの法則 V/T = k (一定) より V = kT (原点を通る直線)
B→C この過程の任意の点 X の圧力を P, 体積を V, 絶対温度を T とする.
理想気体の状態方程式より PV = nRT, P₀V₀ = nRT₀
直線 BC の式は P = −(P₀/V₀)V + 3P₀
T = (PV)/(nR) = −(P₀/(nRV₀))V² + (3P₀/(nR))V = −(T₀/V₀²)V² + (3T₀/V₀)V
T = −(T₀/V₀²)(V² − 3V₀V)
= −(T₀/V₀²)(V − 3/2 V₀)² + 9/4 T₀
∴ 最高温度は 9/4 T₀ (V = 3/2 V₀)
[説明文]
定積変化 A→B と定圧変化 C→A の T–V グラフは容易に図示できる.
問題は B→C である. P–V グラフで直線なので等温変化ではなく, T–V グラフも直線ではない.
そこで, 数学的に P と V の関係を T と V の関係に変換することになる. これは決して難しくはない。
単に, 直線 BC の式と常に成り立つ PV = nRT から P を消去し, T = (V の式) にすればよい。
文字が多くて複雑に見えるが, P, V, T 以外はすべて定数である。
仮に P₀ = V₀ = n = R = 1, P = y, V = x, T = z とすると,
y = −x + 3 と yx = z を z = (x の式) に変形しているにすぎない。
また, P₀, V₀ から T₀ への変換を早めにしておくと式が簡潔になる。
結局, T は V の 2 次関数となり, 平方完成によって最高温度が求まる。
本問の図形的意味を右図で確認する(図は削除済み)。
温度一定のときボイルの法則 PV = k (一定) より, P–V 図で等温の曲線は反比例のグラフとなる。
また, 物質量が一定ならばボイル・シャルルの法則 PV/T = k が成立し, PV が増えると T も増える。
つまり, 原点から離れるほど高温の等温曲線となる。
よって, 直線 BC と反比例のグラフ PV = k が接する点でサイクル中の最高温度になる。
本問の場合, P = 3/2 P₀, V = 3/2 V₀ のときであり,
(PV)/T = (P₀V₀)/T₀ より T = 9/4 T₀ である。
(3) 経路 B→C 上の体積 V の点を X とし, このときの圧力を P とする.
ΔU(B→X) = 3/2 nRΔT = 3/2 Δ(PV) = 3/2 (PV − 2P₀V₀)
= −(3P₀/(2V₀))V² + (9/2)P₀V − 3P₀V₀
W(B→X) = 1/2 (P + 2P₀)(V − V₀)
= −(P₀/(2V₀))V² + 3P₀V − (5/2)P₀V₀
Q正味(B→X) = ΔU(B→X) + W(B→X)
= −(2P₀/V₀)V² + (15/2)P₀V − (11/2)P₀V₀
Q正味(B→X) = −(2P₀/V₀)(V − 15/8 V₀)² + 49/32 P₀V₀
V = 15/8 V₀ のとき最大値 49/32 P₀V₀
[説明文]
B→C は定圧・定積・等温・断熱変化ではなく, 公式で直接 Q正味 を求めることはできない。
(2) と同様, 数学的に P と V の関係を Q正味 と V の関係に変換することになる。
さて, (2) の
T = −(T₀/V₀²)(V − 3/2 V₀)² + 9/4 T₀
は, 任意の点 X の瞬間の T(状態量)を表していた。
一方, Q は瞬間の値(状態量)ではなく, 過程の最初からその瞬間までの合計(区間量)である。
つまり, 点 B から任意の点 X までの合計を V の関数で表して図示することになる。
温度 T を表す (2) では T₀ にそろえたが, (3) では P₀, V₀ にそろえるほうが楽である。
PV = nRT において n が一定のとき,
P が一定なら PΔV = nRΔT
V が一定なら ΔP·V = nRΔT
本問のように P も V も一定でない場合, Δ(PV) = nRΔT となる。
X(V, P), B(V₀, 2P₀) より,
Δ(PV)(B→X) = PV − 2P₀V₀ となる。
(2) で求めた直線 BC の式を代入すると, ΔU(B→X) が V の 2 次関数となる。
W(B→X) は, 線分 BX の下側の台形の面積である。
ΔU = 3/2 nRΔT より T が最大のとき ΔU が最大となる一方, Wout は V が増えるほど大きくなる。
Q正味 = ΔU + Wout であるから,
T が最大になる V の値と Q正味 が最大になる V の値は一致しない。
(4) V = 15/8 V₀ のときを状態 D とする。
e = Wall / Qin
= (W(A→B) + W(B→C) + W(C→A)) / (Q(A→B) + Q(B→D))
= (0 + 3/2 P₀V₀ − P₀V₀) / (3/2 P₀V₀ + 49/32 P₀V₀)
= 16/97
[説明文]
熱効率の定義は
e = (正味の仕事) / (実際に吸収した熱量)
であり, 分母に放熱過程を含めてはならない。
定積 A→B は常に吸熱過程, 定圧 C→A は常に放熱過程だが, (3) より B→C は途中で切り替わる。
Q正味 は点 B から点 X までの合計であり, これが増加している 15/8 V₀ までが吸熱過程である。
その後 Q正味 が減少に転じたことは, 15/8 V₀ 以降が放熱過程であることを意味している。
正味の仕事は結局サイクル内の面積である。
なお, T₀ は P₀V₀ = nRT₀ で P₀, V₀ に変換した。

