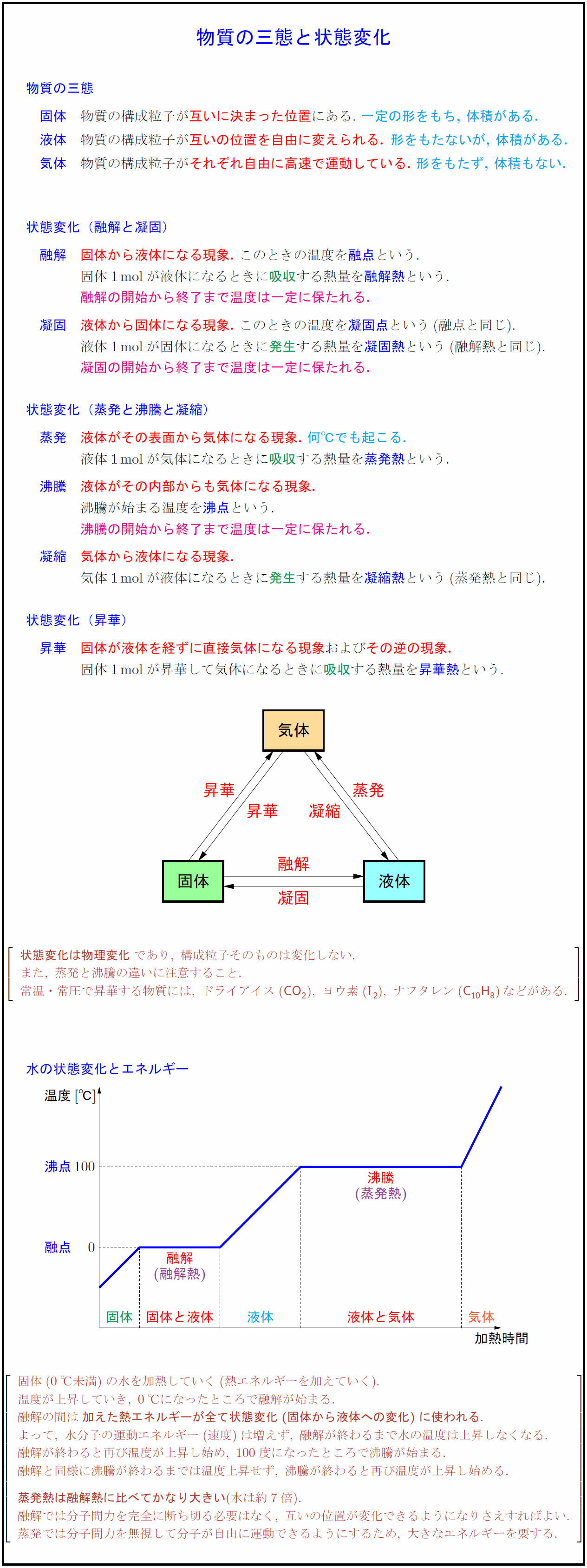
物質の三態 固体 物質の構成粒子が互いに決まった位置にある.\ 一定の形をもち,\ 体積がある. 液体 物質の構成粒子が互いの位置を自由に変えられる. 形をもたないが,\ 体積がある. 気体 物質の構成粒子がそれぞれ自由に高速で運動している.\ 形をもたず,\ 体積もない.状態変化(融解と凝固) 融解 固体から液体になる現象.\ このときの温度を融点という. 固体1molが液体になるときに吸収する熱量を融解熱という. 融解の開始から終了まで温度は一定に保たれる. 凝固 液体から固体になる現象.\ このときの温度を凝固点という(融点と同じ). 発生する熱量を凝固熱という(融解熱と同じ). 凝固の開始から終了まで温度は一定に保たれる. 状態変化(蒸発と沸騰と凝縮) 蒸発 液体がその表面から気体になる現象.\ 何℃でも起こる. 液体1molが気体になるときに吸収する熱量を蒸発熱という. 沸騰 液体がその内部からも気体になる現象. 沸騰が始まる温度を沸点という. 沸騰の開始から終了まで温度は一定に保たれる. 凝縮 気体から液体になる現象. 気体1molが液体になるときに発生する熱量を凝縮熱という(蒸発熱と同じ). 状態変化(昇華) 昇華 固体が液体を経ずに直接気体になる現象およびその逆の現象. 固体1molが昇華して気体になるときに吸収する熱量を昇華熱という. {状態変化は物理変化}であり,\ 構成粒子そのものは変化しない. また,\ 蒸発と沸騰の違いに注意すること. 常温・常圧で昇華する物質には,\ ドライアイス(CO₂),\ ヨウ素(I}{₂}),\ ナフタレン({C10H8})などがある. 水の状態変化とエネルギー{加熱温度[℃]融解}(融解熱沸騰蒸発熱) 固体(0℃未満)の水を加熱していく(熱エネルギーを加えていく). 温度が上昇していき,\ 0℃になったところで融解が始まる. 融解の間は{加えた熱エネルギーが全て状態変化(固体から液体への変化)に使われる}. よって,\ 水分子の運動エネルギー(速度)は増えず,\ 融解が終わるまで水の温度は上昇しなくなる. 融解が終わると再び温度が上昇し始め,\ 100度になったところで沸騰が始まる. 融解と同様に沸騰が終わるまでは温度上昇せず,\ 沸騰が終わると再び温度が上昇し始める. {蒸発熱は融解熱に比べてかなり大きい}(水は約7倍). 融解では分子間力を完全に断ち切る必要はなく,\ 互いの位置が変化できるようになりさえすればよい. 蒸発では分子間力を無視して分子が自由に運動できるようにするため,\ 大きなエネルギーを要する.

