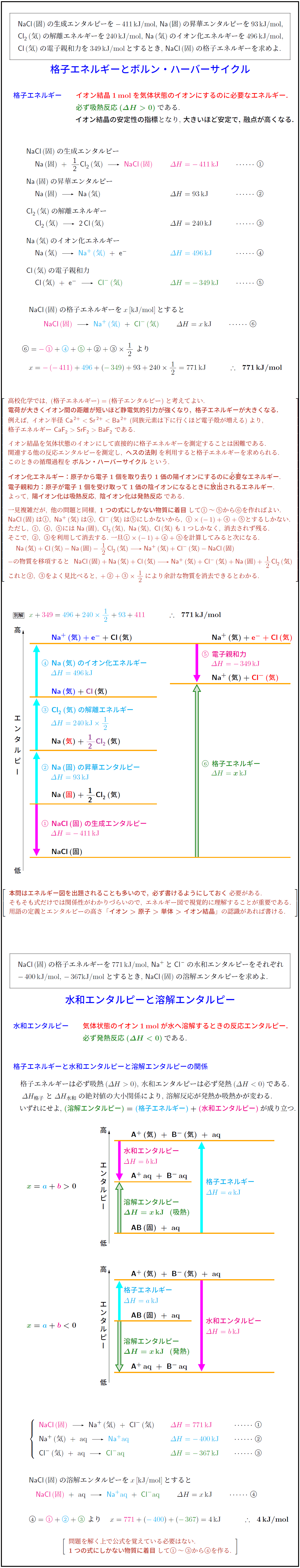
格子エネルギー イオン結晶1 molを気体状態のイオンにするのに必要なエネルギー.
必ず吸熱反応(ΔH > 0)である.
イオン結晶の安定性の指標となり, 大きいほど安定で, 融点が高くなる.
NaCl(固)の生成エンタルピー
Na(固) + 1/2 Cl₂(気) → NaCl(固) ΔH = -411 kJ ・・・①
Na(固)の昇華エンタルピー
Na(固) → Na(気) ΔH = 93 kJ ・・・②
Cl₂(気)の解離エネルギー
Cl₂(気) → 2Cl(気) ΔH = 240 kJ ・・・③
Na(気)のイオン化エネルギー
Na(気) → Na⁺(気) + e⁻ ΔH = 496 kJ ・・・④
Cl(気)の電子親和力
Cl(気) + e⁻ → Cl⁻(気) ΔH = -349 kJ ・・・⑤
NaCl(固)の格子エネルギーを x [kJ/mol] とすると,
NaCl(固) → Na⁺(気) + Cl⁻(気) ΔH = x kJ ・・・⑥
⑥ = -① + ④ + ⑤ + ② + ③ × 1/2 より
x = -(-411) + 496 + (-349) + 93 + 240 × 1/2 = 771 kJ
∴ 771 kJ/mol
高校化学では, (格子エネルギー) = (格子エンタルピー) と考えてよい.
電荷が大きく, イオン間の距離が短いほど静電気的引力が強くなり, 格子エネルギーが大きくなる.
例えば, イオン半径 Ca²⁺ < Sr²⁺ < Ba²⁺ (同族元素は下に行くほど電子殻が増える) より,
格子エネルギー CaF₂ > SrF₂ > BaF₂ である.
イオン結晶を気体状態のイオンにして直接的に格子エネルギーを測定することは困難である.
関連する他の反応エンタルピーを測定し, ヘスの法則を利用すると格子エネルギーを求められる.
このときの循環過程をボルン・ハーバーサイクルという.
イオン化エネルギー:原子から電子1個を取り去り1価の陽イオンにするのに必要なエネルギー.
電子親和力:原子が電子1個を受け取って1価の陰イオンになるときに放出されるエネルギー.
したがって, 陽イオン化は吸熱反応, 陰イオン化は発熱反応である.
一見複雑だが, 他の問題と同様, 1つの式にしかない物質に着目して①~⑤から⑥を作ればよい.
NaCl(固)は①, Na⁺(気)は④, Cl⁻(気)は⑤にしかないから, ①×(-1) + ④ + ⑤ とするしかない.
ただし, ①, ④, ⑤には Na(固), Cl₂(気), Na(気), Cl(気) も1つしかなく, 消去されず残る.
そこで②, ③を利用して消去する.
一旦 ①×(-1) + ④ + ⑤ を計算してみると次になる.
Na(気) + Cl(気) – Na(固) – 1/2 Cl₂(気) → Na⁺(気) + Cl⁻(気) – NaCl(固)
この – の物質を移項すると,
NaCl(固) + Na(気) + Cl(気) → Na⁺(気) + Cl⁻(気) + Na(固) + 1/2 Cl₂(気)
これと②, ③をよく見比べると, +② + ③×1/2 により余計な物質を消去できるとわかる.
x + 349 = 496 + 240×1/2 + 93 + 411
∴ 771 kJ/mol
水和エンタルピーと溶解エンタルピー
水和エンタルピー 気体状態のイオン1 molが水へ溶解するときの反応エンタルピー.
必ず発熱反応(ΔH < 0)である.
格子エネルギーと水和エンタルピーと溶解エンタルピーの関係
格子エネルギーは必ず吸熱(ΔH > 0), 水和エンタルピーは必ず発熱(ΔH < 0)である.
ΔH(格子) と ΔH(水和) の絶対値の大小関係により, 溶解反応が発熱か吸熱かが変わる.
いずれにせよ, (溶解エンタルピー) = (格子エネルギー) + (水和エンタルピー) が成り立つ.
NaCl(固) → Na⁺(気) + Cl⁻(気) ΔH = 771 kJ ・・・①
Na⁺(気) + aq → Na⁺(aq) ΔH = -400 kJ ・・・②
Cl⁻(気) + aq → Cl⁻(aq) ΔH = -367 kJ ・・・③
NaCl(固)の溶解エンタルピーを x [kJ/mol] とすると,
NaCl(固) + aq → Na⁺(aq) + Cl⁻(aq) ΔH = x kJ ・・・④
④ = ① + ② + ③ より,
x = 771 + (-400) + (-367) = 4 kJ
∴ 4 kJ/mol
問題を解く上で公式を覚えている必要はない.
1つの式にしかない物質に着目して①~③から④を作る.

