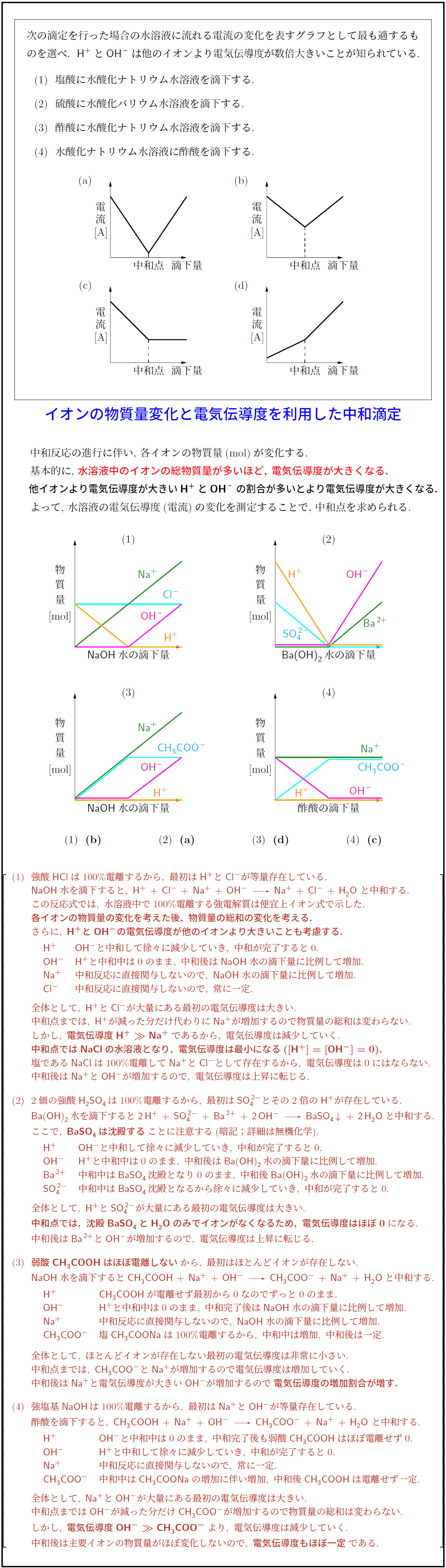
次の滴定を行った場合の水溶液に流れる電流の変化を表すグラフとして最も適するものを選べ.
H⁺とOH⁻は他のイオンより電気伝導度が数倍大きいことが知られている.
(1) 塩酸に水酸化ナトリウム水溶液を滴下する.
(2) 硫酸に水酸化バリウム水溶液を滴下する.
(3) 酢酸に水酸化ナトリウム水溶液を滴下する.
(4) 水酸化ナトリウム水溶液に酢酸を滴下する.
(1) (b) (2) (a) (3) (d) (4) (c)
電気伝導度を利用した中和滴定
中和反応の進行に伴い, 各イオンの物質量molが変化する.
基本的に, 水溶液中のイオンの総物質量が多いほど, 電気伝導度が大きくなる.
他イオンより電気伝導度が大きいH⁺とOH⁻の割合が多いとより電気伝導度が大きくなる.
よって, 水溶液の電気伝導度(電流)の変化を測定することで, 中和点を求められる.
(1) 強酸HClは100%電離するから, 最初はH⁺とCl⁻が等量存在している.
NaOH水を滴下すると, H⁺ + Cl⁻ + Na⁺ + OH⁻ → Na⁺ + Cl⁻ + H₂O と中和する.
ここでは, 水溶液中で100%電離する物質はあえてイオンで示した.
各イオンの物質量の変化を考えた後, 物質量の総和の変化を考える.
さらに, H⁺とOH⁻の電気伝導度が他のイオンより大きいことも考慮する.
H⁺ OH⁻と中和して徐々に減少していき, 中和が完了すると0.
OH⁻ H⁺と中和中は0のまま, 中和後はNaOH水の滴下量に比例して増加.
Na⁺ 中和反応に直接関与しないので, NaOH水の滴下量に比例して増加.
Cl⁻ 中和反応に直接関与しないので, 常に一定.
全体として, H⁺とCl⁻が大量にある最初の電気伝導度は大きい.
中和点までは, H⁺が減った分だけ代わりにNa⁺が増加するので物質量の総和は変わらない.
しかし, 電気伝導度H⁺>>Na⁺であるから, 電気伝導度は減少していく.
中和点ではNaClの水溶液となり, 電気伝導度は最小になる([H⁺]=[OH⁻]=0).
塩であるNaClは100%電離してNa⁺とCl⁻として存在するから, 電気伝導度は0にはならない.
中和後はNa⁺とOH⁻が増加するので, 電気伝導度は上昇に転じる.
(2) 2価の強酸H₂SO₄は100%電離するから, 最初はSO₄²⁻とその2倍のH⁺が存在している.
Ba(OH)₂水を滴下すると2H⁺ + SO₄²⁻ + Ba²⁺ + 2OH⁻ → BaSO₄↓ + 2H₂Oと中和する.
ここで, BaSO₄は沈殿することに注意する(暗記; 詳細は無機化学).
H⁺ OH⁻と中和して徐々に減少していき, 中和が完了すると0.
OH⁻ H⁺と中和中は0のまま, 中和後はBa(OH)₂水の滴下量に比例して増加.
Ba²⁺ 中和中はBaSO₄沈殿となり0のまま, 中和後Ba(OH)₂水の滴下量に比例して増加.
SO₄²⁻ 中和中はBaSO₄沈殿となるから徐々に減少していき, 中和が完了すると0.
全体として, H⁺とSO₄²⁻が大量にある最初の電気伝導度は大きい.
中和点では, 沈殿BaSO₄とH₂Oのみでイオンがなくなるため, 電気伝導度はほぼ0になる.
中和後はBa²⁺とOH⁻が増加するので, 電気伝導度は上昇に転じる.
(3) 弱酸CH₃COOHはほぼ電離しないから, 最初はほとんどイオンが存在しない.
NaOH水を滴下するとCH₃COOH + Na⁺ + OH⁻ → CH₃COO⁻ + Na⁺ + H₂Oと中和する.
H⁺ CH₃COOHが電離せず最初から0なのでずっと0のまま.
OH⁻ H⁺と中和中は0のまま, 中和完了後はNaOH水の滴下量に比例して増加.
Na⁺ 中和反応に直接関与しないので, NaOH水の滴下量に比例して増加.
CH₃COO⁻ 塩CH₃COONaは100%電離するから, 中和中は増加, 中和後は一定.
全体として, ほとんどイオンが存在しない最初の電気伝導度は非常に小さい.
中和点までは, CH₃COO⁻とNa⁺が増加するので電気伝導度は増加していく.
中和後はNa⁺と電気伝導度が大きいOH⁻が増加するので電気伝導度の増加割合が増す.
(4) 強塩基NaOHは100%電離するから, 最初はNa⁺とOH⁻が等量存在している.
酢酸を滴下すると, CH₃COOH + Na⁺ + OH⁻ → CH₃COO⁻ + Na⁺ + H₂O と中和する.
H⁺ OH⁻と中和中は0のまま, 中和完了後も弱酸CH₃COOHはほぼ電離せず0.
OH⁻ H⁺と中和して徐々に減少していき, 中和が完了すると0.
Na⁺ 中和反応に直接関与しないので, 常に一定.
CH₃COO⁻ 中和中はCH₃COONaの増加に伴い増加, 中和後CH₃COOHは電離せず一定.
全体として, Na⁺とOH⁻が大量にある最初の電気伝導度は大きい.
中和点まではOH⁻が減った分だけCH₃COO⁻が増加するので物質量の総和は変わらない.
しかし, 電気伝導度OH⁻ >> CH₃COO⁻より, 電気伝導度は減少していく.
中和後はどのイオンの物質量も変化しないので, 電気伝導度も一定である.

