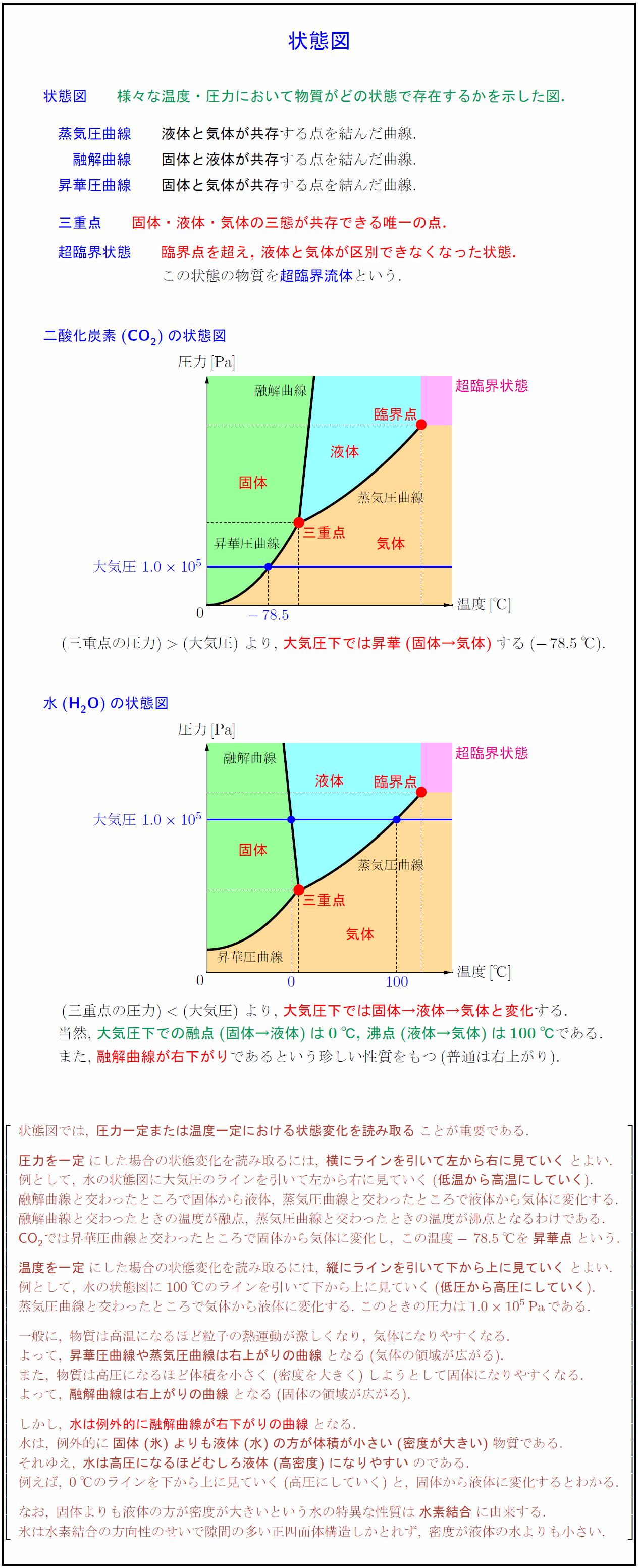
状態図 様々な温度・圧力において物質がどの状態で存在するかを示した図. 蒸気圧曲線} 液体と気体が共存}する点を結んだ曲線. 融解曲線} 固体と液体が共存}する点を結んだ曲線. 昇華圧曲線} 固体と気体が共存}する点を結んだ曲線. 三重点 固体・液体・気体の三態が共存できる唯一の点. 超臨界状態 臨界点を超え,\ 液体と気体が区別できなくなった状態. この状態の物質を超臨界流体という. 二酸化炭素(CO₂)の状態図 $(三重点の圧力)(大気圧)$大気圧下では昇華(固体→気体)する($-78.5$℃). {(.6,.54)}[se]{三重点} 臨界点} 蒸気圧曲線 昇華圧曲線 融解曲線超臨界状態 $(三重点の圧力)(大気圧)$\ より,\ 大気圧下では固体→液体→気体と変化する. 当然,\ 大気圧下での融点(固体→液体)は0℃,\ 沸点(液体→気体)は100℃である. また,\ 融解曲線が右下がりであるという珍しい性質をもつ(普通は右上がり). 状態図では,\ {圧力一定または温度一定における状態変化を読み取る}ことが重要である. {圧力を一定}にした場合の状態変化を読み取るには,\ {横にラインを引いて左から右に見ていく}とよい. 例として,\ 水の状態図に大気圧のラインを引いて左から右に見ていく({低温から高温にしていく}). 融解曲線と交わったところで固体から液体,\ 蒸気圧曲線と交わったところで液体から気体に変化する. 融解曲線と交わったときの温度が融点,\ 蒸気圧曲線と交わったときの温度が沸点となるわけである. CO₂では昇華圧曲線と交わったところで固体から気体に変化し,\ この温度-78.5℃を{昇華点}という. {温度を一定}にした場合の状態変化を読み取るには,\ {縦にラインを引いて下から上に見ていく}とよい. 例として,\ 水の状態図に100℃のラインを引いて下から上に見ていく({低圧から高圧にしていく}). 蒸気圧曲線と交わったところで気体から液体に変化する.\ このときの圧力は1.010⁵Pa}である. 一般に,\ 物質は高温になるほど粒子の熱運動が激しくなり,\ 気体になりやすくなる. よって,\ {昇華圧曲線や蒸気圧曲線は右上がりの曲線}となる(気体の領域が広がる). また,\ 物質は高圧になるほど体積を小さく(密度を大きく)しようとして固体になりやすくなる. よって,\ {融解曲線は右上がりの曲線}となる(固体の領域が広がる). しかし,\ {水は例外的に融解曲線が右下がりの曲線}となる. 水は,\ 例外的に{固体(氷)よりも液体(水)の方が体積が小さい(密度が大きい)}物質である. それゆえ,\ {水は高圧になるほどむしろ液体(高密度)になりやすい}のである. 例えば,\ 0℃のラインを下から上に見ていく(高圧にしていく)と,\ 固体から液体に変化するとわかる. なお,\ 固体よりも液体の方が密度が大きいという水の特異な性質は{水素結合}に由来する. 氷は水素結合の方向性のせいで隙間の多い正四面体構造しかとれず,\ 密度が液体の水よりも小さい.

