シャルルの法則の説明欄に「物質量と温度が一定ならば」とありますが、「物質量と圧力が一定ならば」の誤りですm(_ _)m
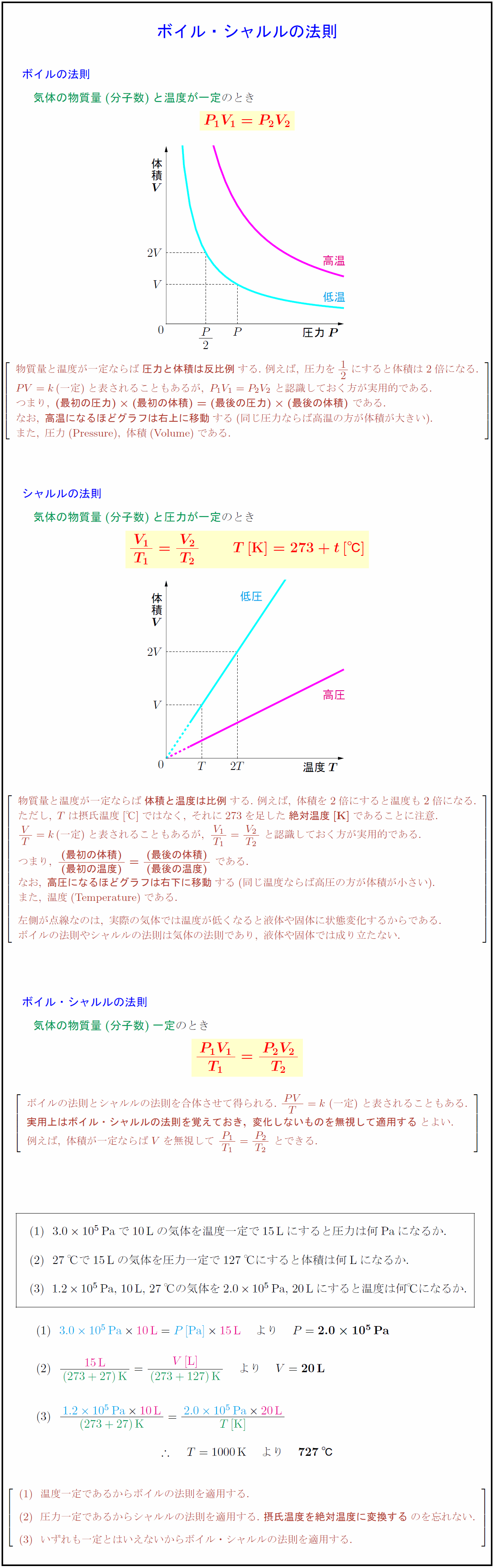
気体の物質量(分子数)と温度が一定のとき 物質量と温度が一定ならば{圧力と体積は反比例}する.\ 例えば,\ 圧力を12にすると体積は2倍になる. PV=k(一定)と表されることもあるが,\ P₁V₁=P₂V₂\ と認識しておく方が実用的である. つまり,\ {(最初の圧力)(最初の体積)=(最後の圧力)(最後の体積)}\ である. なお,\ {高温になるほどグラフは右上に移動}する(同じ圧力ならば高温の方が体積が大きい). また,\ 圧力(Pressure}),\ 体積(Volume})である. 気体の物質量(分子数)と圧力が一定のとき 物質量と温度が一定ならば{体積と温度は比例}する.\ 例えば,\ 体積を2倍にすると温度も2倍になる. ただし,\ Tは摂氏温度[℃]ではなく,\ それに273を足した{絶対温度[K}]}であることに注意. VT=k(一定)と表されることもあるが,\ {V₁}{T₁}={V₂}{T₂}\ と認識しておく方が実用的である. つまり,\ (最初の体積)}{(最初の温度)}={(最後の体積)}{(最後の温度)\ である. なお,\ {高圧になるほどグラフは右下に移動}する(同じ温度ならば高圧の方が体積が小さい). また,\ 温度(Temperature})である. 気体の物質量(分子数)一定 ボイルの法則とシャルルの法則を合体させて得られる. {実用上はボイル・シャルルの法則を覚えておき,\ 変化しないものを無視して適用する}とよい. 例えば,\ 体積が一定ならばVを無視して\ {P₁}{T₁}={P₂}{T₂}\ とできる. }]$ 3.010⁵$Paで10Lの気体を温度一定で15Lにすると圧力は何Paになるか. 27℃で15Lの気体を圧力一定で127℃にすると体積は何Lになるか. $1.210⁵$Pa,\ 10L,\ 27℃の気体を$2.010⁵$Pa,\ 20Lにすると温度は何℃になるか. 温度一定であるからボイルの法則を適用する. 圧力一定であるからシャルルの法則を適用する.\ {摂氏温度を絶対温度に変換する}のを忘れない. いずれも一定とはいえないからボイル・シャルルの法則を適用する.

