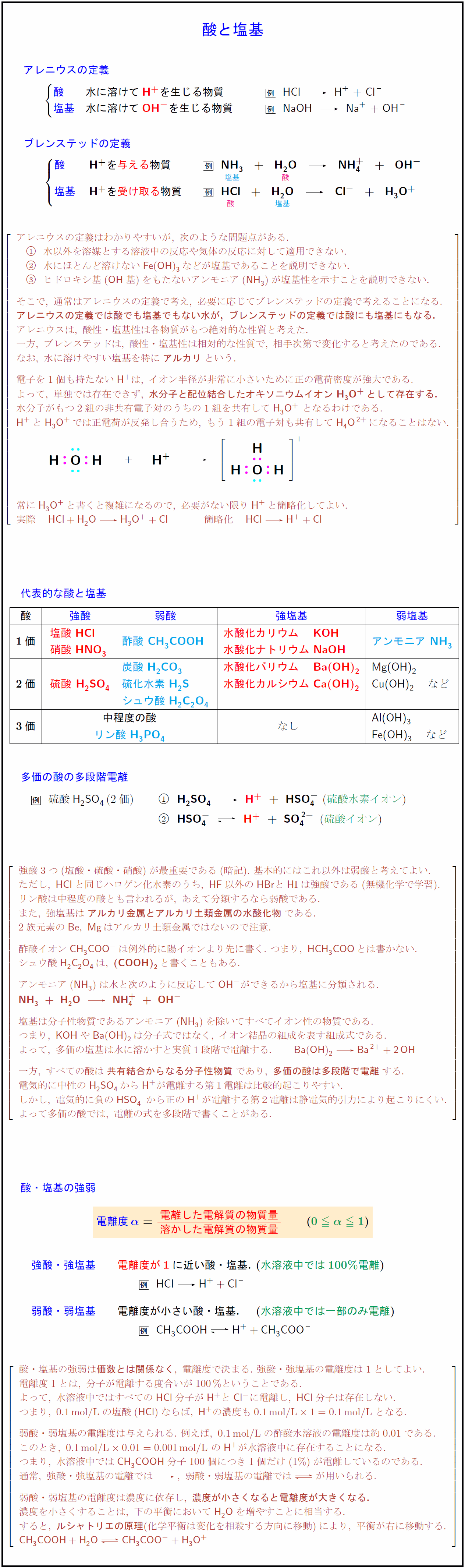
アレニウスの定義} 酸} 水に溶けて{H+を生じる物質 {HCl}\ \ {H+}\ +\ {Cl- 塩基} 水に溶けて{OH-を生じる物質 {NaOH}\ \ {Na+}\ +\ {OH-ブレンステッドの定義} 与える}物質 受け取る}物質 アレニウスの定義はわかりやすいが,\ 次のような問題点がある. 水以外を溶媒とする溶液中の反応や気体の反応に対して適用できない. 水にほとんど溶けない{Fe(OH)3}などが塩基であることを説明できない. ヒドロキシ基({OH}基)をもたないアンモニア(NH₃)が塩基性を示すことを説明できない. そこで,\ 通常はアレニウスの定義で考え,\ 必要に応じてブレンステッドの定義で考えることになる. {アレニウスの定義では酸でも塩基でもない水が,\ ブレンステッドの定義では酸にも塩基にもなる.} アレニウスは,\ 酸性・塩基性は各物質がもつ絶対的な性質と考えた. 一方,\ ブレンステッドは,\ 酸性・塩基性は相対的な性質で,\ 相手次第で変化すると考えたのである. なお,\ 水に溶けやすい塩基を特に{アルカリ}という. 電子を1個も持たない{H+}は,\ イオン半径が非常に小さいために正の電荷密度が強大である. よって,\ 単独では存在できず,\ {水分子と配位結合したオキソニウムイオン\ {H3O+}として存在する.} 水分子がもつ2組の非共有電子対のうちの1組を共有して{H3O+}\ となるわけである. {H+}と{H3O+}では正電荷が反発し合うため,\ もう1組の電子対も共有して{H4O²+}になることはない. ₀ 常に{H3O+}と書くと複雑になるので,\ 必要がない限り{H+}と簡略化してよい. 実際 {HCl + H₂O H3O+ + Cl-} 簡略化 {HCl H+ + Cl-} 酸{強酸} 弱酸}強塩基} 弱塩基} \hfill 2}*{1価 塩酸\ {HCl}酢酸\ {CH₃COOH水酸化カリウム \ {KOHアンモニア NH₃} 硝酸\ {HNO₃水酸化ナトリウム\ {NaOH} 3}*{2価{硫酸\ {H₂SO₄炭酸\ {H₂CO₃水酸化バリウム \ {Ba(OH)₂Mg(OH)₂ 硫化水素\ {H₂S 水酸化カルシウム\ {Ca(OH)₂Cu(OH)₂} など} シュウ酸\ {H₂C2O4 2}*{3価 中程度の酸} Al(OH)3 リン酸\ {H₃PO₄{Fe(OH)3} など} 多価の酸の多段階電離 硫酸{H₂SO₄}(2価) $H₂SO₄}{H+\ +\ {HSO₄-$\ (硫酸水素イオン}) {硫酸{H₂SO₄}(2価) }$HSO₄-}{H+\ +\ {SO₄²-$\ (硫酸イオン}) 強酸3つ(塩酸・硫酸・硝酸)が最重要である(暗記).\ 基本的にはこれ以外は弱酸と考えてよい. ただし,\ {HCl}と同じハロゲン化水素のうち,\ {HF}以外の{HBr}と{H}{I}は強酸である(無機化学で学習). リン酸は中程度の酸とも言われるが,\ あえて分類するなら弱酸である. また,\ 強塩基は{アルカリ金属とアルカリ土類金属の水酸化物}である. 2族元素の{Be},\ {Mg}はアルカリ土類金属ではないので注意. 酢酸イオン{CH₃COO-}は例外的に陽イオンより先に書く.\ つまり,\ {HCH₃COO}とは書かない. シュウ酸{H₂C2O4}は,\ (COOH)₂と書くこともある. アンモニア(NH₃)は水と次のように反応して{OH-}ができるから塩基に分類される. {NH₃\ +\ H₂O{NH₄+}\ +\ {OH- 塩基は分子性物質であるアンモニア(NH₃)を除いてすべてイオン性の物質である. つまり,\ {KOH}や{Ba(OH)₂}は分子式ではなく,\ イオン結晶の組成を表す組成式である. よって,\ 多価の塩基は水に溶かすと実質1段階で電離する. {Ba(OH)₂ Ba²+ + 2OH-} 一方,\ すべての酸は{共有結合からなる分子性物質}であり,\ {多価の酸は多段階で電離}する. 電気的に中性の{H₂SO₄}から{H+}が電離する第1電離は比較的起こりやすい. しかし,\ 電気的に負の{HSO₄-}から正の{H+}が電離する第2電離は静電気的引力により起こりにくい. よって多価の酸では,\ 電離の式を多段階で書くことがある. 酸・塩基の強弱電離度α}={電離した電解質の物質量}{溶かした電解質の物質量 強酸・強塩基} 電離度が1}に近い酸・塩基.\ (水溶液中では100\%電離})} {HCl -H+ + Cl-} 弱酸・弱塩基} 電離度が小さい酸・塩基. (水溶液中では一部のみ電離})} {CH₃COOH H+ + CH₃COO-} $[l} 酸・塩基の強弱は価数とは関係なく},\ 電離度で決まる.\ 強酸・強塩基の電離度は1としてよい. 水溶液中では,\ {HCl}分子が100個あればすべて{H+}と{Cl-}に電離し,\ {HCl}分子は存在しない. \ 弱酸・弱塩基の電離度は与えられる.\ 例えば,\ 0.1mol/L}の酢酸水溶液の電離度は約0.01である. このとき,\ 0.1mol/L}0.01=0.001mol/L}\ の{H+}が水溶液中に存在することになる. つまり,\ 水溶液中ではCH₃COOH分子100個につき1個だけ(1\%)が電離しているのである. 通常,\ 強酸・強塩基の電離では\ 弱酸・弱塩基の電離では{<=>}が用いられる. 弱酸・弱塩基の電離度は濃度に依存し,\ {濃度が小さくなると電離度が大きくなる.} 濃度を小さくすることは,\ 下の平衡においてH₂Oを増やすことに相当する. すると,\ {ルシャトリエの原理}(化学平衡は変化を相殺する方向に移動)により,\ 平衡が右に移動する. {CH₃COOH + H₂O <=> CH₃COOH + H3O+}

