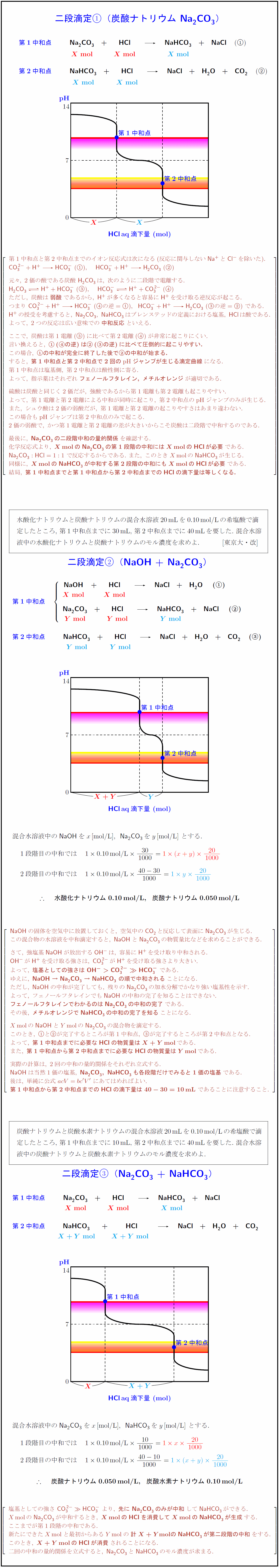
第1中和点と第2中和点までのイオン反応式は次になる(反応に関与しない{Na+}と{Cl-}を除いた). {CO₃²- + H+ HCO₃-}\ (), {HCO₃- + H+ H₂CO₃}\ () 元々,\ 2価の酸である炭酸\ {H₂CO₃}は,\ 次のように二段階で電離する. {H₂CO₃ H+ + HCO₃-}\ (), {HCO₃- <=> H+ + CO₃²-}\ () ただし,\ 炭酸は{弱酸}であるから,\ {H+}が多くなると容易に{H+}を受け取る逆反応が起こる. つまり\ {CO₃²- + H+ HCO₃-}\ (の逆=),{HCO₃- + H+ H₂CO₃}\ (の逆=)\ である. {H+}の授受を考慮すると,\ {Na2CO₃},\ {NaHCO₃}はブレンステッドの定義における塩基,\ {HCl}は酸である. よって,\ 2つの反応は広い意味での{中和反応}といえる. ここで,\ 炭酸は第1電離()に比べて第2電離()が非常に起こりにくい. 言い換えると,\ {(の逆)は(の逆)に比べて圧倒的に起こりやすい.} この場合,\ {の中和が完全に終了した後での中和が始まる.} すると,\ {第1中和点と第2中和点で2回のpH}ジャンプが生じる滴定曲線}になる. 第1中和点は塩基側,\ 第2中和点は酸性側に寄る. よって,\ 指示薬はそれぞれ{フェノールフタレイン,\ メチルオレンジ}が適切である. 硫酸は炭酸と同じく2価だが,\ 強酸であるから第1電離も第2電離も起こりやすい. よって,\ 第1電離と第2電離による中和が同時に起こり,\ 第2中和点のpH}ジャンプのみが生じる. また,\ シュウ酸は2価の弱酸だが,\ 第1電離と第2電離の起こりやすさはあまり違わない. この場合もpH}ジャンプは第2中和点のみで起こる. 2価の弱酸で,\ かつ第1電離と第2電離の差が大きいからこそ炭酸は二段階で中和するのである. 最後に,\ Na2CO₃}の二段階中和の量的関係}を確認する. 化学反応式より,\ {Xmol}の{Na2CO₃}の第1段階の中和にはXmol}の{HCl}が必要}である. {Na2CO₃}:{HCl}=1:1\ で反応するからである.\ また,\ このときXmol}の{NaHCO₃}が生じる. 同様に,\ {Xmol}の{NaHCO₃}が中和する第2段階の中和にもXmol}の{HCl}が必要}である. 結局,\ {第1中和点までと第1中和点から第2中和点までの{HCl}の滴下量は等しくなる.} 水酸化ナトリウムと炭酸ナトリウムの混合水溶液20mLを0.10mol/Lの希塩酸で滴 定したところ,\ 第1中和点までに30mL,\ 第2中和点までに40mLを要した.\ 混合水溶 液中の水酸化ナトリウムと炭酸ナトリウムのモル濃度を求めよ. [東京大・改] 二段滴定({NaOH}\ +\ {Na2CO₃}) 混合水溶液中の{NaOH}を$x$[mol/L],{Na2CO₃}を$y$[mol/L]\ とする. 水酸化ナトリウム\ 0.10mol/L,炭酸ナトリウム\ 0.050mol/L}$} {NaOH}の固体を空気中に放置しておくと,\ 空気中のCO₂と反応して表面に{Na2CO₃}が生じる. この混合物の水溶液を中和滴定すると,\ {NaOH}と{Na2CO₃}の物質量比などを求めることができる. さて,\ 強塩基{NaOH}が放出する{OH-}は容易に{H+}を受け取り中和される. {OH-}が{H+}を受け取る強さは,\ {CO₃²-}が{H+}を受け取る強さより大きい. よって,\ {塩基としての強さは\ {OH-}{CO₃²-}\gg{HCO₃-\ である. ゆえに,\ NaOH}\ →\ {Na2CO₃}\ →\ {NaHCO₃}\ の順で中和される}ことになる. ただし,\ {NaOH}の中和が完了しても,\ 残りの{Na2CO₃}の加水分解でかなり強い塩基性を示す. よって,\ フェノールフタレインでも{NaOH}の中和の完了を知ることはできない. {フェノールフタレインでわかるのは{Na2CO₃}の中和の完了}である. その後,\ {メチルオレンジで{NaHCO₃}の中和の完了を知る}ことになる. Xmol}の{NaOH}とYmol}の{Na2CO₃}の混合物を滴定する. このとき,\ とが完了するところが第1中和点,\ が完了するところが第2中和点となる. よって,\ {第1中和点までに必要な{HCl}の物質量はX+Ymol}である. また,\ {第1中和点から第2中和点までに必要な{HCl}の物質量はYmol}である. 実際の計算は,\ 2回の中和の量的関係をそれぞれ立式する. {NaOH}は当然1価の塩基,\ Na2CO₃},\ {NaHCO₃}も各段階だけでみると1価の塩基}である. 後は,\ 単純に公式\ acV=bc’V’\ にあてはめればよい. {第1中和点から第2中和点までの{HCl}の滴下量は\ 40-30=10mL}\ であることに注意すること. 炭酸ナトリウムと炭酸水素ナトリウムの混合水溶液20mLを0.10mol/Lの希塩酸で滴 定したところ,\ 第1中和点までに10mL,\ 第2中和点までに40mLを要した.\ 混合水溶 液中の炭酸ナトリウムと炭酸水素ナトリウムのモル濃度を求めよ. 二段滴定({Na2CO₃}\ +\ {NaHCO₃}) 混合水溶液中の{Na2CO₃}を$x$[mol/L],{NaHCO₃}を$y$[mol/L]\ とする. 1段階目の中和では $10.10mol/L}{10}{1000}=1 x{20}{1000$ 2段階目の中和では $10.10mol/L}{40-10}{1000}=1 (x+y){20}{1000$ $ {炭酸ナトリウム\ 0.050mol/L,炭酸水素ナトリウム\ 0.10mol/L}$} 塩基としての強さ\ {CO₃²-}\gg{HCO₃-}\ より,\ {先に\ {Na2CO₃}のみが中和}して{NaHCO₃}ができる. Xmol}の{Na2CO₃}が中和するとき,\ {Xmol}の{HCl}を消費してXmol}の{NaHCO₃}が生成}する. ここまでが第1段階の中和である. 新たにできたXmol}と最初からあるYmol}の{計X+Ymolの{NaHCO₃}が第二段階の中和}をする. このとき,\ {X+Ymolの{HCl}が消費}されることになる. 二回の中和の量的関係を立式すると,\ {Na2CO₃}と{NaHCO₃}のモル濃度が求まる.

