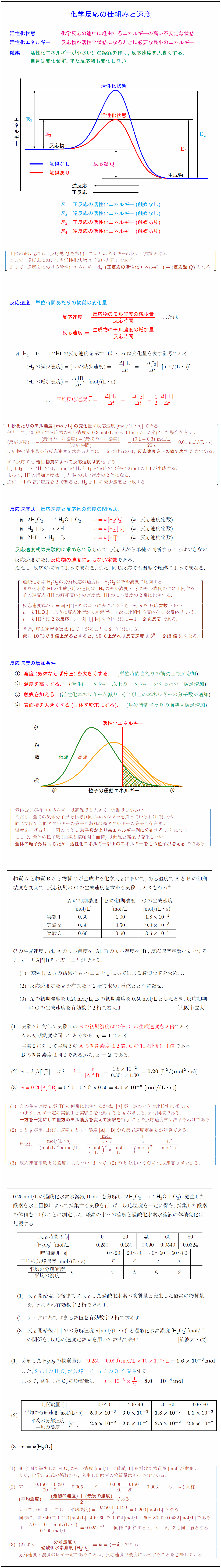
活性化状態 化学反応の途中に経由するエネルギーの高い不安定な状態. 活性化エネルギー 反応物が活性化状態になるときに必要な最小のエネルギー. 触媒 活性化エネルギーが小さい別の経路を作り,\ 反応速度を大きくする. 自身は変化せず,\ また反応熱も変化しない. {(-0.05,1)}[n]{活性化状態} {(-0.05,.5)}[n]{活性化状態} {(-1.5,-.25)}[e]{触媒なし} {(-1.5,-.4)}[e]{触媒あり} {(0,-.25)}[w]{反応熱Q} {(-1.5,0)}[ne]{反応物 {(1.5,-0.5)}[nw]{生成物 {(-.6,-.73)}[w]{正反応 {(-.6,-.62)}[w]{逆反応 E₁ 正反応の活性化エネルギー(触媒なし)$} ${E₂ 逆反応の活性化エネルギー(触媒なし)$} ${E₃ 正反応の活性化エネルギー(触媒あり)$} ${E₄ 逆反応の活性化エネルギー(触媒あり)$} $[l} 上図の正反応では,\ 反応熱Qを放出してよりエネルギーの低い生成物となる. ここで,\ 逆反応においても活性化状態は正反応と同じである. よって,\ 逆反応における活性化エネルギーは,\ {(正反応の活性化エネルギー)+(反応熱Q)}となる. 単位時間あたりの物質の変化量. ${反応速度={反応物のモル濃度の減少量}{反応時間}$ または ${反応速度={生成物のモル濃度の増加量}{反応時間}$ $H₂+{I}_2{2H}{I}$\ の反応速度を示す.\ 以下,\ $Δ$は変化量を表す記号である. $(H₂の減少速度)=({I}_2の減少速度)=-{Δ [{H₂}]}{Δ t}=-{Δ [{I}_2]}{Δ t}\ [mol/(L・s)}]$ 1秒あたりのモル濃度[mol/L}]の変化量}が反応速度[mol/(L・s)}]である. 例として,\ 20秒間で反応物のモル濃度が0.3mol/L}から0.1mol/L}に変化した場合を考える. (反応速度)=-{(最後のモル濃度)-(最初のモル濃度)}{(反応時間)}=-{(0.1-0.3)\ mol/L{20\ s=0.01\ mol/(L・s)} 反応物の減少量から反応速度を求めるときに-をつけるのは,\ {反応速度を正の値で表す}ためである. 同じ反応でも{着目物質によって反応速度は変化}する. よって,\ {H}I}の増加速度はH₂と{I}_2の減少速度の2倍になる. 逆に,\ {H}I}の増加速度を2で割ると,\ H₂と{I}_2の減少速度と一致する. 反応速度と反応物の濃度の関係式. $(k:反応速度定数)$ 反応速度式は実験的に求められるもので,\ 反応式から単純に判断することはできない. 反応速度定数は反応物の濃度によらない定数である. ただし,\ 反応の種類によって異なる.\ また,\ 同じ反応でも温度や触媒によって異なる. 過酸化水素H₂O₂の分解反応の速度は,\ H₂O₂のモル濃度に比例する. ヨウ化水素{H}{I}の生成反応の速度は,\ H₂のモル濃度と{I}_2のモル濃度の積に比例する. その逆反応({H}{I}の解離反応)の速度は,\ {H}{I}のモル濃度の2乗に比例する. 反応速度式が\ v=k[A}]^x[B}]^y\ のように表されるとき,\ x,\ yを{反応次数}という. v=k[H₂O₂]のように反応速度がモル濃度の1次に比例する反応を{1次反応}という. v=k[{H}I}]²は{2次反応},\ v=k[H₂][I}_2]も全体では1+1={2次反応}である. 普通,\ 反応速度定数は10℃上がることに2,\ 3倍になる. 仮に{10℃で3倍上がるとすると,\ 50℃上がれば反応速度は3⁵=243倍}にもなる. 反応速度の増加条件 濃度(気体ならば分圧)を大きくする. (単位時間当たりの衝突回数が増加}) 温度を高くする. (活性化エネルギー以上のエネルギーをもった分子数が増加}) 触媒を加える.(活性化エネルギーが減り,\ それ以上のエネルギーの分子数が増加}) 表面積を大きくする(固体を粉末にする). (単位時間当たりの衝突回数が増加}) 粒子の運動エネルギー 活性化エネルギー} 気体分子が持つエネルギーは高温ほど大きく,\ 低温ほど小さい. ただし,\ 全ての気体分子がそれぞれ同じエネルギーを持っているわけではない. 同じ温度でも低エネルギーの分子もあれば高エネルギーの分子も存在する. 温度を上げると,\ 上図のように{粒子数がより高エネルギー側に分布する}ことになる. ここで,\ 全体の粒子数(曲線と横軸間の面積)は低温と高温で変化しない. {全体の粒子数は同じだが,\ 活性化エネルギー以上のエネルギーをもつ粒子が増える}のである. 物質Aと物質Bから物質Cが生成する化学反応において,\ ある温度でAとBの初期 濃度を変えて,\ 反応初期のCの生成速度を求める実験1,\ 2,\ 3を行った. Aの初期濃度 Bの初期濃度 Cの生成速度 Cの生成速度$v$は,\ Aのモル濃度を[A],\ Bのモル濃度を[B],\ 反応速度定数を$k$とする と,\ $v=k[A}]^x[B}]^y$\ と表すことができる. 実験1,\ 2,\ 3の結果をもとに,\ $x$と$y$にあてはまる適切な値を求めよ. 反応速度定数$k$を有効数字2桁で求め,\ 単位とともに記せ. Aの初期濃度を0.20mol/L,\ Bの初期濃度を0.50mol/Lとしたとき,\ 反応初期 のCの生成速度を有効数字2桁で答えよ. [大阪市立大] 実験2に対して実験1のBの初期濃度は2倍,\ Cの生成速度も2倍}である. { }Aの初期濃度は同じであるから,\ ${y=1}$\ である. { }実験2に対して実験3のAの初期濃度は2倍,\ Cの生成速度は4倍}である. { }Bの初期濃度は同じであるから,\ ${x=2}$\ である. C}の生成速度vが[B}]の何乗に比例するかは,\ [A}]が一定のときで比較すればよい. つまり,\ A}が一定の実験1と実験2を比較するとyが求まる.\ xも同様である. {一方を一定にして他方のモル濃度を変えて実験を行う}ことで反応速度式が決まるわけである. xとyが定まれば,\ 速度vとモル濃度[A}],\ [B}]から反応速度定数kが逆算できる. 反応速度定数kは濃度によらない.\ よって,\ のkを用いてC}の生成速度vが求まる. 0.25mol/Lの過酸化水素水溶液10mLを分解し({2H₂O₂ – 2H₂O + O₂}),\ 発生した 酸素を水上置換によって捕集する実験を行った.\ 反応温度を一定に保ち,\ 捕集した酸素 の体積を20秒ごとに測定した.\ 酸素の水への溶解と過酸化水素水溶液の体積変化は 無視する. 反応開始40秒後までに反応した過酸化水素の物質量と発生した酸素の物質量 を,\ それぞれ有効数字2桁で求めよ. ア~クにあてはまる数値を有効数字2桁で求めよ. 反応開始後$t$[s]での分解速度$v$[mol/(L・s)]と過酸化水素濃度[H₂O₂][mol/L] の関係を,\ 反応の速度定数$k$を用いて数式で表せ. [筑波大・改] 分解したH₂O₂の物質量は\ { }また,\ 2molのH₂O₂が分解して1molのO₂が発生}する. { }よって,\ 発生したO₂の物質量は 時間範囲 平均の分解速度}{平均の濃度}$ ${v=k[H₂O₂]}$ 40秒間で減少したH₂O₂のモル濃度[mol/L}]に体積[L]}を掛けて物質量[mol]}が求まる. また,\ 化学反応式の係数から,\ 発生した酸素の物質量はその半分である. {(平均濃度)={(最初の濃度)+(最後の濃度)}{2\ である. 同様に計算すると,\ カ,\ キ,\ クも同じ値となる. より,\ 分解速度\ v}{過酸化水素濃度\ [H₂O₂]}=k=(一定)}\ である. 分解速度と濃度の比が一定であることは,\ 反応速度が濃度に比例することを意味している.

