酸化物と水の反応、酸化物の中和反応の詳細については以下ページへ。

酸化物の分類、酸化物と水の反応
定期試験・大学入試に特化した解説、暗記事項まとめ。酸化物と水の反応を体系的に整理。酸性酸化物・塩基性酸化物・両性酸化物・中性酸化物の違いを例とともに解説。オキソ酸の生成原理や例外反応(NO₂, COなど)も詳しく説明。

酸化物の分類、酸化物の中和反応
定期試験・大学入試に特化した解説、暗記事項まとめ。酸化物と酸・塩基の中和反応を体系的に整理。酸性酸化物・塩基性酸化物・両性酸化物の分類から、反応原理・生成する塩・水の有無まで詳しく解説。CO₂, CaO, SO₂, Na₂Oなど代表例を通し、無機反応を原理から理解できる。
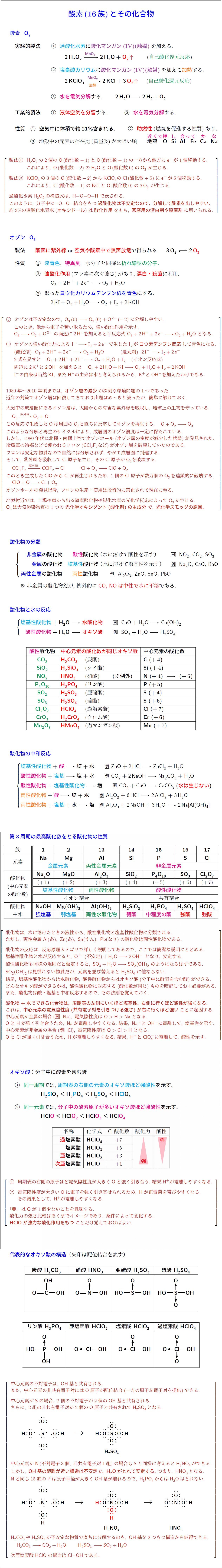
酸素(16族)とその化合物
酸素 O₂
実験的製法
① 過酸化水素に酸化マンガン(IV)(触媒)を加える.
2H₂O₂ →[MnO₂] 2H₂O + O₂↑ (自己酸化還元反応)
② 塩素酸カリウムに酸化マンガン(IV)(触媒)を加えて加熱する.
2KClO₃ →[MnO₂][加熱] 2KCl + 3O₂↑ (自己酸化還元反応)
③ 水を電気分解する. 2H₂O → 2H₂ + O₂
工業的製法
① 液体空気を分留する.
② 水を電気分解する.
性質
① 空気中に体積で約21%含まれる.
② 助燃性(燃焼を促進する性質)あり.
③ 地殻中の元素の存在比(質量%)が大きい順:
O > Si > Al > Fe > Ca > Na
[補足]
製法①:H₂O₂の2個のO(酸化数-1)のうち, 一方から他方へ電子が1個移動することで,
O(酸化数-2)のH₂OとO(酸化数0)のO₂が生じる.
製法②:KClO₃の3個のO(酸化数-2)からCl(酸化数+5)へ電子が6個移動することで,
Cl(酸化数-1)のKClとO(酸化数0)の3O₂が生じる.
過酸化水素H₂O₂の構造式はH–O–O–Hであり, 分子中に -O–O- 結合をもつ過酸化物は不安定なので,
分解して酸素を出しやすい. 約3%の過酸化水素水(オキシドール)は酸化作用をもち,
家庭用の漂白剤や殺菌剤に用いられる.
オゾン O₃
製法
酸素に紫外線を照射するか, 空気や酸素中で無声放電を行うことで得られる.
3O₂ ⇄ 2O₃
性質
① 淡青色, 特異臭, 折れ線型の分子.
② 強い酸化作用(フッ素に次ぐ強さ)があり, 漂白・殺菌に利用される.
O₃ + 2H⁺ + 2e⁻ → O₂ + H₂O
③ 湿ったヨウ化カリウムデンプン紙を青色にする.
2KI + O₃ + H₂O → O₂ + I₂ + 2KOH
補足
オゾンは不安定で, O₃(0) → O₂(0) + O²⁻(-2)に分解しやすい.
このとき他から電子を奪うため, 強い酸化作用を示す.
O₃ → O₂ + O²⁻ の両辺に2H⁺を加えると半反応式 O₃ + 2H⁺ + 2e⁻ → O₂ + H₂O となる.
この酸化力によってI⁻ → I₂ + 2e⁻が起こり, 生じたI₂がヨウ素デンプン反応して青色になる.
(酸化剤) O₃ + 2H⁺ + 2e⁻ → O₂ + H₂O
(還元剤) 2I⁻ → I₂ + 2e⁻
2式を足すと, O₃ + 2H⁺ + 2I⁻ → O₂ + H₂O + I₂
両辺に2K⁺と2OH⁻を加えると, O₃ + 2H₂O + 2KI → O₂ + H₂O + I₂ + 2KOH
1980~2010年頃までは, オゾン層の減少が深刻な環境問題の1つであったが,
近年の対策で回復傾向にある.
成層圏のオゾン層は, 太陽からの紫外線を吸収して地球上の生物を守っている.
O₃ →[紫外線] O₂ + O
生成したOは周囲のO₂と反応してO₃を再生する. O + O₂ → O₃
この分解と再生サイクルによりオゾン濃度は一定に保たれている.
しかし, 1980年代に北極・南極上空でオゾンホールが発見され,
冷媒などに使われたフロン(CCl₂F₂など)がオゾンを破壊することが判明した.
CCl₂F₂ →[紫外線] CClF₂ + Cl
Cl + O₃ → ClO + O₂
ClO + O → Cl + O₂
この連鎖により1個のCl原子が数万個のO₃を破壊する.
以後フロンは段階的に禁止された.
地表付近では, NOxや炭化水素の光化学反応によりO₃が生成し,
光化学スモッグの原因となる光化学オキシダントの主成分となる.
酸化物の分類
非金属の酸化物 → 酸性酸化物(水に溶けて酸性)例:NO₂, CO₂, SO₃
金属の酸化物 → 塩基性酸化物(水に溶けて塩基性)例:Na₂O, CaO, BaO
両性金属の酸化物 → 両性酸化物 例:Al₂O₃, ZnO, SnO, PbO
※ 非金属の酸化物でもCO, NOは中性で水に不溶。
酸化物と水の反応
塩基性酸化物 + H₂O → 水酸化物 例:CaO + H₂O → Ca(OH)₂
酸性酸化物 + H₂O → オキソ酸 例:SO₃ + H₂O → H₂SO₄
酸化物の中和反応
塩基性酸化物 + 酸 → 塩 + 水 例:ZnO + 2HCl → ZnCl₂ + H₂O
酸性酸化物 + 塩基 → 塩 + 水 例:CO₂ + 2NaOH → Na₂CO₃ + H₂O
酸性酸化物 + 塩基性酸化物 → 塩 例:CO₂ + CaO → CaCO₃(水は生じない)
両性酸化物 + 酸 → 塩 + 水 例:Al₂O₃ + 6HCl → 2AlCl₃ + 3H₂O
両性酸化物 + 塩基 + 水 → 塩 例:Al₂O₃ + 2NaOH + 3H₂O → 2Na[Al(OH)₄]
第3周期の最高酸化数をとる酸化物の性質
族 元素 酸化物 性質
1 Na Na₂O 塩基性酸化物(強塩基性)
2 Mg MgO 塩基性酸化物(弱塩基性)
13 Al Al₂O₃ 両性酸化物
14 Si SiO₂ 酸性酸化物
15 P P₄O₁₀ 酸性酸化物
16 S SO₃ 酸性酸化物
17 Cl Cl₂O₇ 酸性酸化物
左に行くほど塩基性が強く, 右に行くほど酸性が強くなる.
これは中心元素の電気陰性度の増加に起因する.
オキソ酸(酸素を含む酸)
同一周期では右側の元素ほど強酸性.
H₂SiO₃ < H₃PO₄ < H₂SO₄ < HClO₄
同一元素では酸素原子が多いほど強酸性.
HClO < HClO₂ < HClO₃ < HClO₄
酸化数と酸性・酸化力の関係(Clの場合)
名称 化学式 Cl酸化数 酸化力 酸性
過塩素酸 HClO₄ +7 強 強
塩素酸 HClO₃ +5 中 中
亜塩素酸 HClO₂ +3 弱 弱
次亜塩素酸 HClO +1 弱 弱
代表的なオキソ酸の構造(矢印は配位結合)
炭酸 H₂CO₃:O=C(OH)₂
硝酸 HNO₃:O=N(→O)(OH)
亜硫酸 H₂SO₃:O=S(→O)(OH)₂
硫酸 H₂SO₄:O=S(→O)₂(OH)₂
リン酸 H₃PO₄:O=P(→O)(OH)₃
亜塩素酸 HClO₂:HO–Cl(→O)
塩素酸 HClO₃:HO–Cl(→O)₂
過塩素酸 HClO₄:HO–Cl(→O)₃
補足:
中心元素の不対電子はOH基と共有され, 非共有電子対にはO原子が配位結合できる.
Sの場合, 2組の非共有電子対が2個のO原子と共有され, H₂SO₄が生成する.
Nの場合, H₃NO₄が想定されるがOH基が近すぎて不安定でH₂Oが脱離しHNO₃となる.
Pは原子半径が大きく, OH基が離れているためH₃PO₄からH₂Oは脱離しない.
H₂CO₃やH₂SO₃も不安定で, すぐに分解してCO₂ + H₂O, SO₂ + H₂Oとなる.
次亜塩素酸HClOの構造はCl–OHである.

