酸化物と水の反応、酸化物の中和反応の詳細については以下ページへ。

酸化物の分類、酸化物と水の反応
定期試験・大学入試に特化した解説、暗記事項まとめ。塩基性酸化物と水で水酸化物、酸性酸化物と水でオキソ酸ができる。

酸化物の分類、酸化物の中和反応
定期試験・大学入試に特化した解説、暗記事項まとめ。酸性酸化物、塩基性酸化物はそれぞれ塩基、酸と中和反応し、塩と水ができる。酸性酸化物と塩基性酸化物も中和反応する。
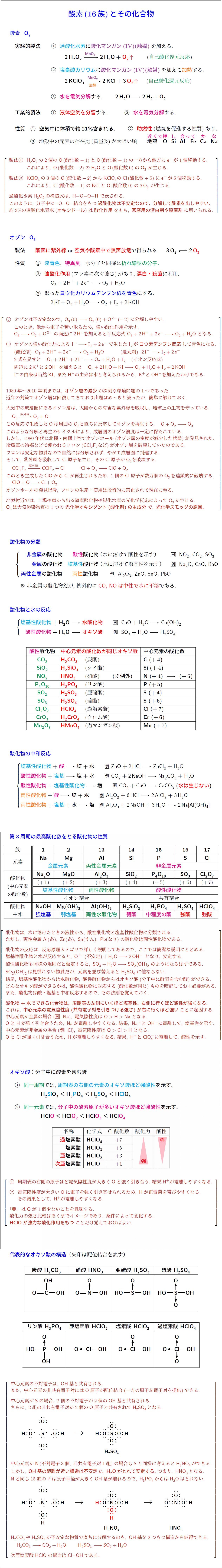
実験的製法} 過酸化水素}}に\textbf{\textcolor{Purple}{酸化マンガン(IV)(触媒)}}を加える. \\[.2zh]
\ \ \bm{\ce{2H2O2 ->[\textcolor{Purple}{\ce{MnO2}}] 2H2O}+\textcolor{red}{\ce{O2 ^}}} 自己酸化還元反応}) \\[1zh]
\maru2\ \ \textbf{\textcolor{cyan}{塩素酸カリウム}}に\textbf{\textcolor{Purple}{酸化マンガン(IV)(触媒)}}を加えて\textbf{\textcolor{orange}{加熱}}する. \\[.2zh]
\ \ \bm{\ce{2KClO3 ->[\textcolor{Purple}{\ce{MnO2}}][\textcolor{orange}{加熱}] 2KCl + 3}\textcolor{red}{\ce{O2 ^}}} 自己酸化還元反応})$ \\[1zh]
\maru3\ \ \textbf{\textcolor{magenta}{水を電気分解}}する. \textbf{\ce{2H2O -> 2H2 + O2}} \\\\
\textbf{工業的製法} \maru1\ \ \textbf{\textcolor{red}{液体空気を分留}}する. \maru2\ \ \textbf{\textcolor{magenta}{水を電気分解}}する. \\\\
\textbf{性質} \maru1\ \ \textbf{空気中に体積で約21\%含まれる.} \maru2\ \ \textbf{\textcolor{red}{助燃性}}(燃焼を促進する性質)あり. \\[.2zh]
\maru3\ \ \textbf{\textcolor{red}{クラーク数}}(地殻中の元素の存在度})\,\textbf{\textcolor{red}{1位}}
製法\maru1\ \ \ce{H2O2}\,の2個の\ce{O}\,(酸化数-1)と\ce{O}\,(酸化数-1)の一方から他方に\ce{e-}\,が1個移動する. \\[.4zh]
\ \ これにより,\ \ce{O}\,(酸化数-2)の\ce{H2O}と\ce{O}\,(酸化数0)の\ce{O_2}\ が生じる. \\[1zh]
製法\maru2\ \ \ce{KClO3}\,の3個の\ce{O}\,(酸化数-2)から\ce{KClO3}の\ce{Cl}\,(酸化数+5)に\ce{e-}\,が6個移動する. \\[.4zh]
\ \ これにより,\ \ce{Cl}\,(酸化数-1)の\ce{KCl}と\ce{O}\,(酸化数0)の\ce{3O_2}\ が生じる. \\[1zh]
過酸化水素\ce{H2O2}\,の構造式は,\ \ce{H-O-O-H}\ で表される. \\[.4zh]
このように,\ 分子中に\ce{- O – O -}結合をもつ\bm{過酸化物は不安定なので,\ 分解して酸素を出しやすい.} \\[.2zh]
約3\%の過酸化水素水(\bm{オキシドール})は\bm{酸化作用}をもち,\ \bm{家庭用の漂白剤や殺菌剤}に用いられる.
オゾン\ \ \ce{O3}}} \\[1zh]
\textbf{製法} \textbf{\textcolor{red}{酸素に紫外線}} or \textbf{\textcolor{red}{空気や酸素中で無声放電}}で得られる. {\boldmath $\ce{3O2 <=> 2}\textcolor{red}{\ce{O3}}$} \\[1zh]
\textbf{性質} \maru1\ \ \textbf{\textcolor{cyan}{淡青色}},\ \ \textbf{\textcolor{magenta}{特異臭}},\ \ 水分子と同様に\textbf{\textcolor[named]{ForestGreen}{折れ線型の分子.}} \\[.5zh]
\maru2\ \ \textbf{\textcolor{red}{強酸化作用}}(フッ素に次ぐ強さ)があり, \textbf{\textcolor{red}{漂白・殺菌}}に利用. \\[.2zh]
\ \ \ce{O3 + 2H+ + 2e- -> O2 + H2O} \\[.5zh]
\maru3\ \ \textbf{湿った\textcolor{blue}{ヨウ化カリウムデンプン紙を青色}にする.} \\[.2zh]
\ \ $\ce{2K}\mathRM{I} + \ce{O3 + H2O -> O2}+\mathRM{I}\ce{_2 + 2KOH}$ \\\\[1zh]
オゾンは不安定なので,\ \ce{O3}\,(0) \ce{-> O2}\,(0) + \ce{O^2-}\,(-\,2)に分解しやすい. \\[.4zh]
\ \ このとき,\ 他から電子を奪い取るため,\ 強い酸化作用を示す. \\[.2zh]
\ \ \ce{O3 -> O2 + O^2-}\ の両辺に\ce{2H+}を加えると半反応式\ \ce{O3 + 2H+ + 2e- -> O2 + H2O}\ となる. \\[1zh]
\maru3\ \ オゾンの強い酸化力による\ \mathRM{I}^- \ce{->} \mathRM{I}\ce{_2 + 2e-}\ で生じた\mathRM{I}\ce{_2}\,が\bm{ヨウ素デンプン反応}して青色になる. \\[.4zh]
\ \ (酸化剤)\ \ \ce{O3 + 2H+ + 2e- -> O2 + H2O} (還元剤)\ \ \ce{2}\mathRM{I}^- \ce{->} \mathRM{I}\ce{_2 + 2e-} \\[.4zh]
\ \ 2式を足すと \ce{O3 + 2H+ +2}\mathRM{I}^- \ce{-> O2 + H2O}+\mathRM{I}\ce{_2} (イオン反応式) \\[.4zh]
\ \ 両辺に\ce{2K+}と\ce{2OH-}を加えると \ce{O3 + 2H2O + K}\mathRM{I} \ce{-> O2 + H2O}+\mathRM{I}\ce{_2 + 2KOH} \\[.4zh]
\ \ \mathRM{I}^-の由来は当然\ce{K}\mathRM{I},\ また\ce{H+}の由来は水と考えられるから,\ \ce{K+}と\ce{OH-}を加えたわけである. \\\\[1zh]
1980年~2010年頃までは,\ \bm{オゾン層の減少}が深刻な環境問題の1つであった. \\[.2zh]
近年の対策でオゾン層は回復してきており出題はめっきり減ったが,\ 簡単に触れておく. \\[1zh]
大気中の成層圏にあるオゾン層は,\ 太陽からの有害な紫外線を吸収し,\ 地球上の生物を守っている. \\[.2zh]
\ce{O3 ->[紫外線] O2 + O} \\[.4zh]
この反応で生成した\ce{O}は周囲の\ce{O2}と直ちに反応してオゾンを再生する. \ce{O + O2 -> O3} \\[.4zh]
このような分解と再生のサイクルにより,\ 成層圏のオゾン濃度は一定に保たれている. \\[.2zh]
しかし,\ 1980年代に北極・南極上空でオゾンホール(オゾン層の密度が減少した状態)が発見された. \\[.2zh]
冷蔵庫の冷媒などで使われるフロン(\ce{CCl2F2}など)がオゾン層を破壊していたのである. \\[.4zh]
フロンは安定な物質なので自然には分解されず,\ やがて成層圏に到達する. \\[.2zh]
そして,\ 紫外線を吸収して\ce{Cl}原子を生じ,\ その\ce{Cl}原子が\ce{O3}を破壊する. \\[.2zh]
\ce{CCl2F2 ->[紫外線] CClF2 + Cl} \ce{Cl + O3 -> ClO + O2} \\[.4zh]
このとき生成した\ce{ClO}から\ce{Cl}が再生されるため,\ 1個の\ce{Cl}原子が数万個の\ce{O3}\,を連鎖的に破壊する. \\[.2zh]
\ce{ClO + O -> Cl + O2} \\[.4zh]
オゾンホールの発見以降,\ フロンの生産・使用は段階的に禁止されて現在に至る. \\[1zh]
地表付近では,\ 工場や車から出る窒素酸化物や炭化水素の光化学反応によって\ce{O3}\,が生じる. \\[.2zh]
\ce{O3}\,は大気汚染物質の1つの\bm{光化学オキシダント(酸化剤)の主成分}で,\ \bm{光化学スモッグの原因.}
非金属}の酸化物 \textcolor{magenta}{酸性}酸化物}(水に溶けて酸性を示す) & \hspace{-1zw}\text{\rei\ \ \ce{NO2}, \ce{CO2},\ \ce{SO3}} \\[.2zh]
\bm{\textcolor{blue}{金属}の酸化物 \textcolor{cyan}{塩基性}酸化物}(水に溶けて塩基性を示す) & \hspace{-1zw}\text{\rei\ \ \ce{Na2O},\ \ce{CaO},\ \ce{BaO}} \\[.2zh]
\,\bm{\textcolor{blue}{両性金属}の酸化物 \textcolor{red}{両性}酸化物} \\ce{Al2O3},\ \ce{ZnO},\ \ce{SnO},\ \ce{PbO}}
※\ 非金属の酸化物だが,\ 例外的に\textcolor{red}{\ce{CO},\ \ce{NO}は中性で水に不溶}である. \\\\\\
\textcolor{blue}{\textbf{酸化物と水の反応}
\textcolor{cyan}{塩基性酸化物} + \ce{H2O ->} \textcolor{red}{水酸化物} \text{\rei\ \ \ce{CaO + H2O -> Ca(OH)2}} \\[.2zh]
\textcolor{magenta}{酸性酸化物} + \ce{H2O ->} \textcolor{red}{オキソ酸} \text{\rei\ \ \ce{SO3 + H2O -> H2SO4}}
酸性}酸化物 & \multicolumn{2}{c|}{\textcolor{red}{中心元素の酸化数が同じオキソ酸}} & 中心元素の酸化数 \\ \hline
\textcolor[named]{ForestGreen}{\ce{CO2}} & \textcolor{red}{\ce{H2CO3}} & \text{(炭酸)} & \ce{C}\ (+\,4) \\ \hline
\textcolor[named]{ForestGreen}{\ce{SiO2}} & \textcolor{red}{\ce{H2SiO3}} & \text{(ケイ酸)} & \ce{Si}\ (+\,4) \\ \hline
\textcolor[named]{ForestGreen}{\ce{NO2}} & \textcolor{red}{\ce{HNO3}} & \text{(硝酸)} (\textbf{※例外}) & \ce{N}\ (+\,4)\ \ce{->}\ (+\,5) \\ \hline
\textcolor[named]{ForestGreen}{\ce{P4O_{10}}} & \textcolor{red}{\ce{H3PO4}} & \text{(リン酸)} & \ce{P}\ (+\,5) \\ \hline
\textcolor[named]{ForestGreen}{\ce{SO2}} & \textcolor{red}{\ce{H2SO3}} & \text{(亜硫酸)} & \ce{S}\ (+\,4) \\ \hline
\textcolor[named]{ForestGreen}{\ce{SO3}} & \textcolor{red}{\ce{H2SO4}} & \text{(硫酸)} & \ce{S}\ (+\,6) \\ \hline
\textcolor[named]{ForestGreen}{\ce{Cl2O7}} & \textcolor{red}{\ce{HClO4}} & \text{(過塩素酸)} & \ce{Cl}\ (+\,7) \\\hline
\textcolor[named]{ForestGreen}{\ce{CrO3}} & \textcolor{red}{\ce{H2CrO4}} & \text{(クロム酸)} & \ce{Cr}\ (+\,6) \\\hline
\textcolor[named]{ForestGreen}{\ce{Mn2O7}} & \textcolor{red}{\ce{HMnO4}} & \text{(過マンガン酸)} & \ce{Mn}\ (+\,7)酸化物の中和反応}} \\[1zh]
塩基性酸化物} + \textcolor{magenta}{酸} \ce{->} 塩 + 水 \text{\rei\ \ce{ZnO + 2HCl -> ZnCl2 + H2O}} \\[.2zh]
\textcolor{magenta}{酸性酸化物} + \textcolor{cyan}{塩基} \ce{->} 塩 + 水 \text{\rei\ \ce{CO2 + 2NaOH -> Na2CO3 + H2O}} \\[.2zh]
\textcolor{magenta}{酸性酸化物} + \textcolor{cyan}{塩基性酸化物} \ce{->} 塩 \text{\rei\ \ce{CO2 + CaO -> CaCO3}}\ (\textcolor{red}{水は生じない}) \\[.2zh]
\textcolor{red}{両性酸化物} + \textcolor{magenta}{酸} \ce{->} 塩 + 水 \text{\rei\ \ce{Al2O3 + 6HCl -> 2AlCl3 + 3H2O}} \\[.2zh]
\textcolor{red}{両性酸化物} + \textcolor{cyan}{塩基} + 水 \ce{->} 塩 \text{\rei\ \ce{Al2O3 + 2NaOH + 3H2O -> 2Na[Al(OH)4]}}
第3周期の最高酸化数をとる酸化物の性質}} \\[1zh]
Na2O}} & \bm{\ce{MgO}} & \bm{\ce{Al2O3}} & \bm{\ce{SiO2}} & \bm{\ce{P4O10}} & \bm{\ce{SO3}} & \bm{\ce{Cl2O7塩基性酸化物}}} 両性酸化物}} 酸性酸化物}}} \\\cline{2-8}
& イオン結合} & 共有結合} \\\hline
酸化物 & \bm{\ce{NaOH}} & \bm{\ce{Mg(OH)2}} & \bm{\ce{Al(OH)3}} & \bm{\ce{H2SiO3}} & \bm{\ce{H3PO4}} & \bm{\ce{H2SO4}} & \bm{\ce{HClO4}} \\\cline{2-8}
+水 & \textbf{\textcolor{blue}{強塩基}} & \textbf{\textcolor{cyan}{弱塩基}} & 両性水酸化物}} & \textbf{\textcolor{magenta}{弱酸}} & \textbf{\textcolor{magenta}{中程度の酸}}
酸化物は,\ 水に溶けたときの液性から,\ 酸性酸化物と塩基性酸化物に分類される. \\[.2zh]
ただし,\ 両性金属\ce{Al}(あ),\ \ce{Zn}(あ),\ \ce{Sn}(すん),\ \ce{Pb}(なり)の酸化物は両性酸化物である. \\[1zh]
酸化物の反応は,\ 反応原理カテゴリで詳しく説明してあるので,\ ここでは簡潔な説明にとどめる. \\[.2zh]
塩基性酸化物と水が反応すると,\ \ce{O^2-}\,(不安定) + \ce{H2O -> 2OH^-}\ となり,\ 安定する. \\[.4zh]
酸性酸化物も同様の規則だと仮定すると,\ \ce{SO3 + H2O -> SO2(OH)2}\ のようになるはずである. \\[.4zh]
\ce{SO2(OH)2}\,は見慣れない物質だが,\ 元素を並び替えると\ \ce{H2SO4}\ に他ならない. \\[.4zh]
結局,\ 塩基性酸化物からは水酸化物,\ 酸性酸化物からはオキソ酸(分子中に酸素を含む酸)ができる. \\[.2zh]
どんなオキソ酸ができるかは,\ 酸性酸化物に対応する(酸化数が同じ)ものを暗記しておく必要がある. \\[.2zh]
また,\ 酸化物は酸・塩基と中和反応するので,\ その法則を覚えておく. \\[1zh]
\bm{酸化物+水でできる化合物は,\ 周期表の左側にいくほど塩基性,\ 右側に行くほど酸性が強くなる.} \\[.2zh]
これは,\ \bm{中心元素の電気陰性度(共有電子対を引きつける強さ)が右に行くほど強い}ことに起因する. \\[.2zh]
中心元素が金属の場合(\rei\ \ \ce{Na}),\ 電気陰性度は\ \ce{O}>\ce{H}>\ce{Na}\ となる. \\[.2zh]
\ce{O}と\ce{H}が強く引き合うため,\ \ce{Na}が電離しやすくなる.\ 結果,\ \ce{Na^+}と\ce{OH-}に電離して,\ 塩基性を示す. \\[.2zh]
中心元素が非金属の場合(\rei\ \ \ce{Cl}),\ 電気陰性度は\ \ce{O}>\ce{Cl}>\ce{H}\ となる. \\[.2zh]
\ce{O}と\ce{Cl}が強く引き合うため,\ \ce{H}が電離しやすくなる.\ 結果,\ \ce{H+}と\ce{ClO4-}に電離して,\ 酸性を示す.オキソ酸}:分子中に酸素を含む酸} \\[1zh]
同一周期}}では, \textbf{\textcolor{cyan}{周期表の右側の元素のオキソ酸ほど強酸性}を示す. \\[.2zh]
同一元素}}では, \textbf{\textcolor{magenta}{分子中の酸素原子が多いオキソ酸ほど強酸性}を示す.
次亜塩素酸 亜塩素酸 塩素酸 過塩素酸
名称 \ \ & 化学式 & \ce{Cl}酸化数 & 酸化力 & 酸性\\ \hline
\bm{\textcolor{red}{過}塩素酸} & \bm{\ce{HClO4}} & +7 &
\maru1\ \ 周期表の右側の原子ほど電気陰性度が大きく\ce{O}と強く引き合う.\ 結果\ce{H+}が電離しやすくなる. \\[1zh]
\maru2\ \ 電気陰性度が大きい\ce{O}に電子を強く引き寄せられるため,\ \ce{H}が正電荷を帯びやすくなる. \\[.2zh]
\ \ その結果として,\ \ce{H+}が電離しやすくなる. \\[1zh]
「亜」は\ce{O}が1個少ないことを意味する. \\[.2zh]
酸化力の強さ比較はあくまでイメージであり,\ 条件によって変化する. \\[.2zh]
\bm{\ce{HClO}が強力な酸化作用をもつ}ことだけ覚えておけばよい.
代表的なオキソ酸の構造}}(矢印は配位結合を表す) \\\\
炭酸 \ce{H2CO3} & 硝酸 \ce{HNO3} & 亜硫酸 \ce{H2SO3} & 硫酸 \ce{H2SO4} \\\hline
リン酸 \ce{H3PO4} & 亜塩素酸\ \ce{HClO2} & 塩素酸 \ce{HClO3} & 過塩素酸 \ce{HClO4} \\\hline
中心元素の不対電子は,\ \ce{OH}基と共有される. \\[.2zh]
また,\ 中心元素の非共有電子対には\ce{O}が配位結合(一方の原子が電子対を提供)できる. \\[1zh]
\ce{OH}基の距離が近い構造は不安定で,\ \ce{H2O}がとれて安定する. \\[1zh]
オキソ酸\,\ce{H2CO3}\,や\ce{H2SO3}\,は\ce{OH}基を2つもつ不安定な物質で,\ 直ちに分解する. \\[.4zh]
\ce{H2CO3 -> CO2 + H2O} \ce{H2SO3 -> SO2 + H2O} \\[.4zh]
\ce{P}は原子半径が大きく\ce{OH}基が離れるので,\ \ce{H3PO4}\,からは\ce{H2O}はとれない. \\[1zh]
次亜塩素酸\ce{HClO}の構造は\ce{Cl-OH}である.

