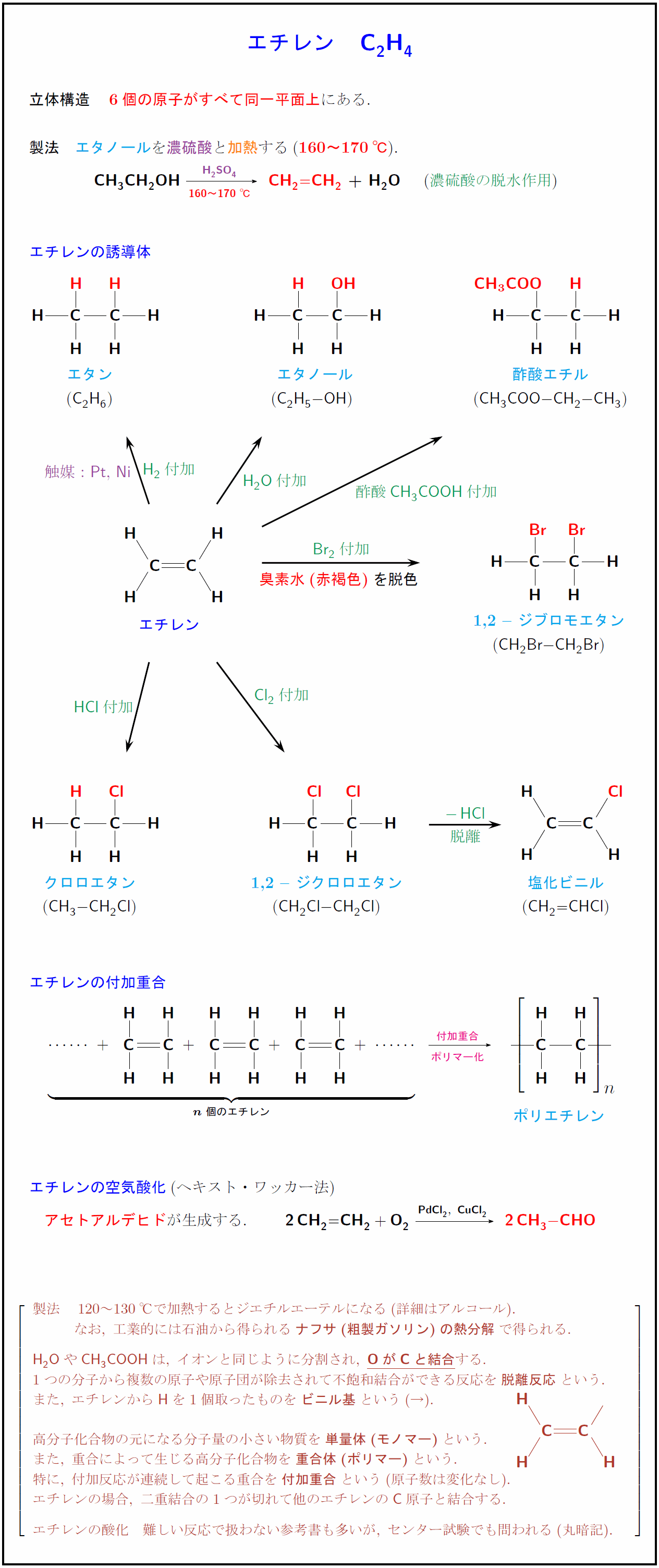
立体構造} 6個の原子がすべて同一平面上にある. 製法} エタノールを\t濃硫酸と\加熱する(160~170℃). CH₃CH₂OH {H₂SO₄][160~170℃]}CH₂=CH₂ + H₂O濃硫酸の脱水作用}) エチレンの誘導体 エチレン クロロエタン ({CH₃-CH₂Cl}) エタン ({C₂H₆}) 1,2 — ジクロロエタン ({CH₂Cl-CH₂Cl}) 塩化ビニル ({CH₂=CHCl}) 1,2 — ジブロモエタン ({CH₂Br-CH₂Br}) エタノール ({C₂H₅-OH}) 酢酸エチル ({CH₃COO-CH₂-CH₃}) CH₃COOH}H₂O}Cl₂}付加}HCl}$脱離} {(-6.3,11.2)}[w]{触媒:{Pt},\ {Ni} {(-1.8,9.1)}[s]{臭素水(赤褐色)}を脱色 エチレンの付加重合付加重合][ポリマー化]} \repeatstr{ }{32}ポリエチレン エチレンの空気酸化(ヘキスト・ワッカー法) アセトアルデヒドが生成する. {2CH₂=CH₂ + O₂ [{PdCl₂},\ {CuCl₂}]} {2CH₃-CHO 製法 120~130℃で加熱するとジエチルエーテルになる(詳細はアルコール). なお,\ 工業的には石油から得られる{ナフサ(粗製ガソリン)の熱分解}で得られる. H₂OやCH₃COOHは,\ イオンと同じように分割され,\ O}が{C}と結合する. 1つの分子から複数の原子や原子団が除去されて不飽和結合ができる反応を{脱離反応}という. また,\ エチレンから{H}を1個取ったものを{ビニル基}という(→). [-2zh] 高分子化合物の元になる分子量の小さい物質を{単量体(モノマー)}という. また,\ 重合によって生じる高分子化合物を{重合体(ポリマー)}という. 特に,\ 付加反応が連続して起こる重合を{付加重合}という(原子数は変化なし). エチレンの場合,\ 二重結合の1つが切れて他のエチレンの{C}原子と結合する. エチレンの酸化 難しい反応で扱わない参考書も多いが,\ センター試験でも問われる(丸暗記).

