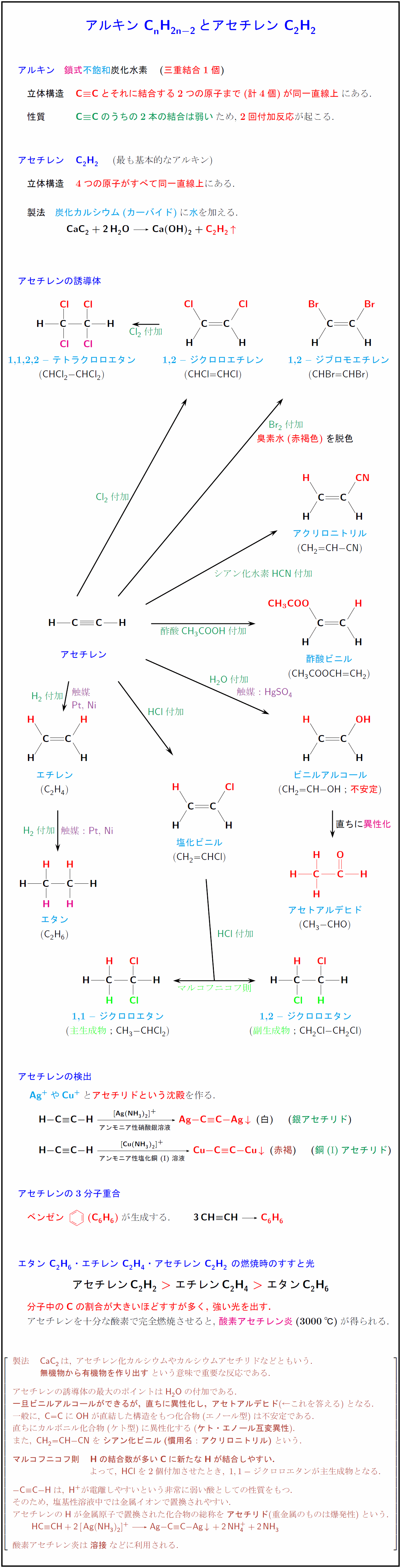
アルキン 鎖式}不飽和}炭化水素 (三重結合1個})} 立体構造とそれに結合する2つの原子まで(計4個)が同一直線上$にある. のうちの2本の結合は弱い$ため,\ 2回付加反応が起こる. アセチレン {C2H₂} (最も基本的なアルキン) 立体構造} 4つの原子がすべて同一直線上にある. 製法} {炭化カルシウム(カーバイド)に水を加える. { ${CaC2 + 2H₂O Ca(OH)₂} + {C2H₂ ^$} アセチレンの誘導体 [-5zh] アセチレン 1,2 — ジブロモエチレン ({CHBr=CHBr}) 1,2 — ジクロロエチレン ({CHCl=CHCl}) 1,1,2,2 — テトラクロロエタン ({CHCl₂-CHCl₂}) エタン ({C₂H₆}) エチレン ({C2H4}) アクリロニトリル ({CH₂=CH-CN}) 酢酸ビニル ({CH₃COOCH=CH₂}) ビニルアルコール ({CH₂=CH-OH};不安定) アセトアルデヒド CH₃-CHO}) 塩化ビニル ({CH₂=CHCl}) 1,1 — ジクロロエタン 主生成物};{CH₃-CHCl₂}) 1,2 — ジクロロエタン 副生成物};{CH₂Cl-CH₂Cl}) HCl}付加}酢酸CH₃COOH付加}Br₂}付加Cl₂}付加}H₂O}付加異性化シアン化水素{HCN}付加}>\X\Y {HCl}付加 \U[s]{マルコフニコフ則 {(1.8,21.3)}[s]{臭素水(赤褐色)}を脱色 {(-7.2,6.75)}[e]{触媒:{Pt},\ {Ni} {(-6.8,11.8)}[e]{触媒 {(-6.8,11.3)}[e]Pt},\ {Ni} {(-.8,11.8)}[e]{触媒:{HgSO₄} アセチレンの検出 {Ag+}や{Cu+}とアセチリドという沈殿を作る. $H-C#C-H [Ag(NH₃)2]+}][アンモニア性硝酸銀溶液]} {Ag-C#C-Ag v\ (白) (銀アセチリド})}$ $H-C#C-H{[Cu(NH₃)2]+}][アンモニア性塩化銅(I})溶液]} {Cu-C#C-Cu v\ ({赤褐}) (銅(I})アセチリド})}$ アセチレンの3分子重合 ベンゼン-.3zw}{\changeunitlength{0.04pt}\parbox[c]{2zw}{\bzdrv({C6H6})が生成する. { ${3CH#CH {C6H6$} エタン {C₂H₆}・エチレン {C2H4}・アセチレン {C2H₂} の燃焼時のすすと光 { $アセチレン{C2H₂}\ エチレン{C2H4}\ >}\ エタン{C₂H₆}$} 分子中の{C}の割合が大きいほどすすが多く,\ 強い光を出す. アセチレンを十分な酸素で完全燃焼させると,\ 酸素アセチレン炎}(3000℃)}が得られる. $[l} 製法 {CaC2}は,\ アセチレン化カルシウムやカルシウムアセチリドなどともいう. {無機物から有機物を作り出す}という意味で重要な反応である. アセチレンの誘導体の最大のポイントはH₂Oの付加である. {一旦ビニルアルコールができるが,\ 直ちに異性化し,\ アセトアルデヒド}(←これを答える)となる. 一般に,\ {C=C}に{OH}が直結した構造をもつ化合物(エノール型)は不安定である. 直ちにカルボニル化合物(ケト型)に異性化する({ケト・エノール互変異性}). また,\ {CH₂=CH-CN}を{シアン化ビニル(慣用名:アクリロニトリル)}という. {マルコフニコフ則 {H}の結合数が多い{C}に新たな{H}が結合しやすい.} よって,\ {HCl}を2個付加させたとき,\ 1,1-ジクロロエタンが主生成物となる. {- C#C-H}は,\ {H+}が電離しやすいという非常に弱い酸としての性質をもつ. そのため,\ 塩基性溶液中では金属イオンで置換されやすい. アセチレンの{H}が金属原子で置換された化合物の総称を{アセチリド}(重金属のものは爆発性)という. {HC#CH + 2[Ag(NH₃)2]+ Ag-C#C-Ag v + 2NH₄+ + 2NH₃} 酸素アセチレン炎は{溶接}などに利用される. %そのため,\ 塩基性溶液中で中和されやすい. %触媒{Hg²+}でビニルアルコール %「触媒として硫酸水銀(II){HgSO₄}を含む希硫酸中にアセチレンを通じる」=H₂O付加

