燃料電池 水素H₂, メタンCH₄, メタノールCH₃OHなどの燃料と空気中の酸素O₂の
燃焼反応で生じる熱エネルギーを直接電気エネルギーに変換する装置で,
エネルギー効率が高い.
1次電池とも2次電池とも異なり, 外部からの燃料追加で永久に使用できる.
その意味では, 電池というよりも発電装置である.
高校化学では, 主にリン酸型とアルカリ型の水素-酸素燃料電池を扱う.
どちらも「水素 + 酸素 → 水」というクリーンな電池である.
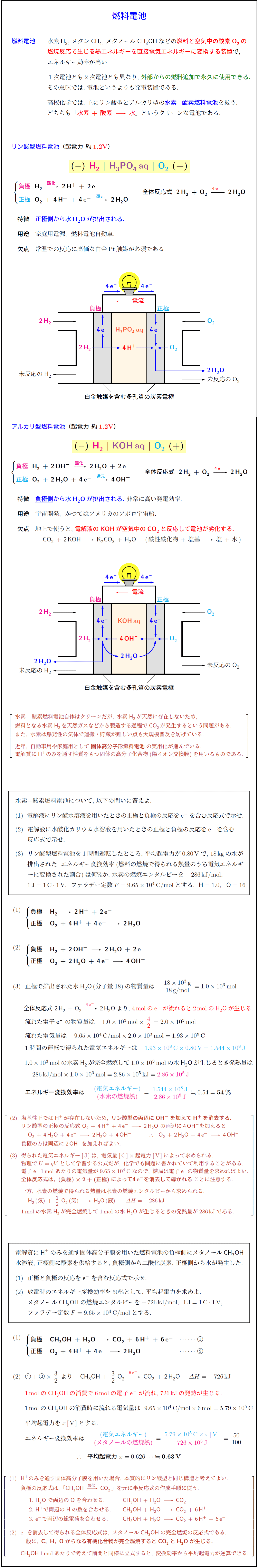
リン酸型燃料電池(起電力 約1.2V)
(−) H₂ | H₃PO₄ aq | O₂ (+)
負極 H₂ →(酸化) 2 H⁺ + 2 e⁻
正極 O₂ + 4 H⁺ + 4 e⁻ →(還元) 2 H₂O
全体反応式 2 H₂ + O₂ →[4 e⁻] 2 H₂O
特徴 正極側から水H₂Oが排出される.
用途 家庭用電源, 燃料電池自動車.
欠点 常温での反応に高価な白金Pt触媒が必須である.
アルカリ型燃料電池(起電力 約1.2V)
(−) H₂ | KOH aq | O₂ (+)
負極 H₂ + 2 OH⁻ →(酸化) 2 H₂O + 2 e⁻
正極 O₂ + 2 H₂O + 4 e⁻ →(還元) 4 OH⁻
全体反応式 2 H₂ + O₂ →[4 e⁻] 2 H₂O
特徴 負極側から水H₂Oが排出される. 非常に高い発電効率.
用途 宇宙開発, かつてはアメリカのアポロ宇宙船.
欠点 地上で使うと, 電解液のKOHが空気中のCO₂と反応して電池が劣化する.
CO₂ + 2 KOH → K₂CO₃ + H₂O (酸性酸化物 + 塩基 → 塩 + 水)
[水素-酸素燃料電池自体はクリーンだが, 水素H₂が天然に存在しないため,
燃料となる水素H₂を天然ガスなどから製造する過程でCO₂が発生するという問題がある.
また, 水素は爆発性の気体で運搬・貯蔵が難しい点も大規模普及を妨げている.
近年, 自動車用や家庭用として固体高分子形燃料電池の実用化が進んでいる.
電解質にH⁺のみを通す性質をもつ固体の高分子化合物(陽イオン交換膜)を用いるものである.]
水素-酸素燃料電池について, 以下の問いに答えよ.
(1) 電解液にリン酸水溶液を用いたときの正極と負極の反応をe⁻を含む反応式で示せ.
(2) 電解液に水酸化カリウム水溶液を用いたときの正極と負極の反応をe⁻を含む反応式で示せ.
(3) リン酸型燃料電池を1時間運転したところ, 平均起電力が0.80 Vで, 18 kgの水が排出された.
エネルギー変換効率(燃料の燃焼で得られる熱量のうち電気エネルギーに変換された割合)は何%か.
水素の燃焼エンタルピーを−286 kJ/mol, 1 J = 1 C·1 V, ファラデー定数F = 9.65×10⁴ C/molとする. H = 1.0, O = 16
(1)
負極 H₂ → 2 H⁺ + 2 e⁻
正極 O₂ + 4 H⁺ + 4 e⁻ → 2 H₂O
(2)
負極 H₂ + 2 OH⁻ → 2 H₂O + 2 e⁻
正極 O₂ + 2 H₂O + 4 e⁻ → 4 OH⁻
(3) 正極で排出された水H₂O(分子量18)の物質量は 18×10³ g / 18 g/mol = 1.0×10³ mol
全体反応式 2 H₂ + O₂ →[4 e⁻] 2 H₂O より, 4 molのe⁻が流れると2 molのH₂Oが生じる.
流れた電子e⁻の物質量は 1.0×10³ mol × (4/2) = 2.0×10³ mol
流れた電気量は 9.65×10⁴ C/mol × 2.0×10³ mol = 1.93×10⁸ C
1時間の運転で得られた電気エネルギーは 1.93×10⁸ C × 0.80 V = 1.544×10⁸ J
1.0×10³ molの水素H₂が完全燃焼して1.0×10³ molの水H₂Oが生じるとき発熱量は
286 kJ/mol × 1.0×10³ mol = 2.86×10⁵ kJ = 2.86×10⁸ J
エネルギー変換効率は (電気エネルギー)/(水素の燃焼熱) = (1.544×10⁸ J)/(2.86×10⁸ J) ≈ 0.54 = 54 %
[(2) 塩基性下ではH⁺が存在しないため, リン酸型の両辺にOH⁻を加えてH⁺を消去する.
リン酸型の正極の反応式 O₂ + 4 H⁺ + 4 e⁻ → 2 H₂O の両辺に4 OH⁻を加えると
O₂ + 4 H₂O + 4 e⁻ → 2 H₂O + 4 OH⁻ ∴ O₂ + 2 H₂O + 4 e⁻ → 4 OH⁻
負極の方は両辺に2 OH⁻を加えればよい.
(3) 得られた電気エネルギー[J]は, 電気量[C] × 起電力[V]によって求められる.
物理でU = qVとして学習する公式だが, 化学でも問題に書かれていて利用することがある.
電子e⁻ 1 molあたりの電気量が9.65×10⁴ Cなので, 結局は電子e⁻の物質量を求めればよい.
全体反応式は, (負極)×2 + (正極)によって4 e⁻を消去して導かれることに注意する.
一方, 水素の燃焼で得られる熱量は水素の燃焼エンタルピーから求められる.
H₂(気) + 1/2 O₂(気) → H₂O(液) ΔH = −286 kJ
1 molの水素H₂が完全燃焼して1 molの水H₂Oが生じるときの発熱量が286 kJである.]
電解質にH⁺のみを通す固体高分子膜を用いた燃料電池の負極側にメタノールCH₃OH水溶液, 正極側に酸素を供給すると, 負極側から二酸化炭素, 正極側から水が発生した.
(1) 正極と負極の反応をe⁻を含む反応式で示せ.
(2) 放電時のエネルギー変換効率を50%として, 平均起電力を求めよ.
メタノールCH₃OHの燃焼エンタルピーを−726 kJ/mol, 1 J = 1 C·1 V, ファラデー定数F = 9.65×10⁴ C/molとする.
(1)
負極 CH₃OH + H₂O → CO₂ + 6 H⁺ + 6 e⁻ …1
正極 O₂ + 4 H⁺ + 4 e⁻ → 2 H₂O …2
(2) 1 + 2×(3/2) より CH₃OH + 3/2 O₂ →[6 e⁻] CO₂ + 2 H₂O ΔH = −726 kJ
1 molのCH₃OHの消費で6 molの電子e⁻が流れ, 726 kJの発熱が生じる.
1 molのCH₃OHの消費時に流れる電気量は 9.65×10⁴ C/mol × 6 mol = 5.79×10⁵ C
平均起電力をx [V]とする.
エネルギー変換効率は (電気エネルギー)/(メタノールの燃焼熱) = (5.79×10⁵ C × x [V])/(726×10³ J) = 50/100
∴ 平均起電力 x = 0.626… ≈ 0.63 V
[(1) H⁺のみを通す固体高分子膜を用いた場合, 本質的にリン酸型と同じ構造と考えてよい.
負極の反応式は, 「CH₃OH →(酸化) CO₂」を元に半反応式の作成手順に従う.
H₂Oで両辺のOを合わせる. CH₃OH + H₂O → CO₂
H⁺で両辺のHの数を合わせる. CH₃OH + H₂O → CO₂ + 6 H⁺
e⁻で両辺の総電荷を合わせる. CH₃OH + H₂O → CO₂ + 6 H⁺ + 6 e⁻
(2) e⁻を消去して得られる全体反応式は, メタノールCH₃OHの完全燃焼の反応式である.
一般に, C, H, Oからなる有機化合物が完全燃焼するとCO₂とH₂Oが生じる.
CH₃OH 1 molあたりで考えて前問と同様に立式すると, 変換効率から平均起電力が逆算できる.]

