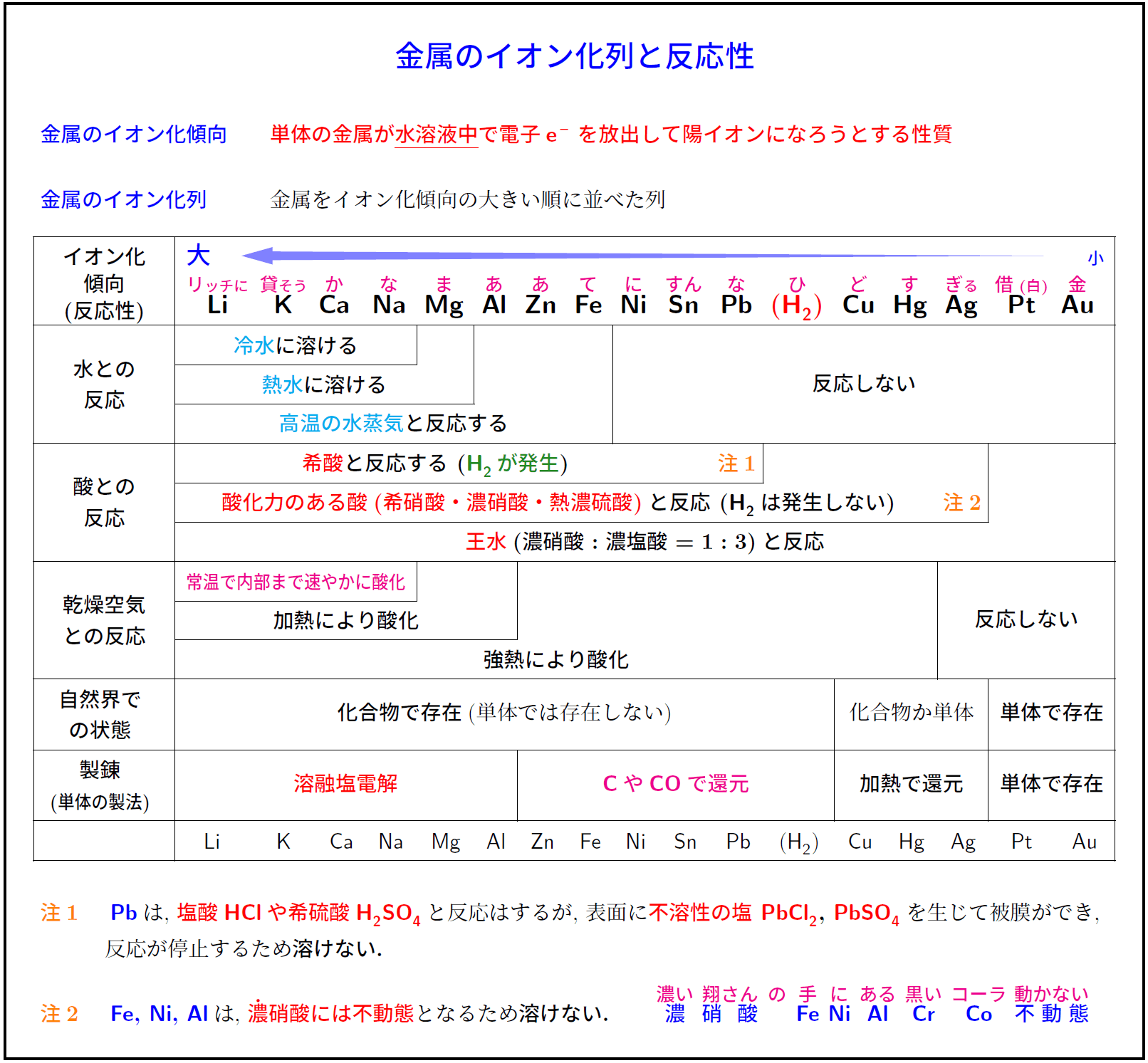
金属のイオン化傾向}} \textbf{\textcolor{red}{単体の金属が\underline{水溶液中}で電子\ce{e-}を放出して陽イオンになろうとする性質}} \\\\
\textbf{\textcolor{blue}{金属のイオン化列}} 金属をイオン化傾向の大きい順に並べた列 \\[1zh]
冷水}に溶ける熱水}に溶ける高温の水蒸気}と反応する酸化力のある酸(希硝酸・濃硝酸・熱濃硫酸)}と反応\ (\ce{H2}は発生しない王水}($\bm{濃硝酸:濃塩酸=1:3}$)と反応乾燥空気との反応常温で内部まで速やかに酸化強熱により酸化自然界での状態化合物で存在}(単体では存在しない化合物か単体空気との直ちに酸化製錬溶融塩電解C}や\ce{CO}で還元}}} & \multicolumn{3}{c|}{\textbf{加熱で還元単体で存在
& \ce{Li} & \ce{K} & \ce{Ca} & \ce{Na} & \ce{Mg} & \ce{Al} & \ce{Zn} & \ce{Fe} & \ce{Ni} & \ce{Sn} & \ce{Pb} & (\ce{H2}) & \ce{Cu} & \ce{Hg} & \ce{Ag} & \ce{Pt} & \ce{Au} \\ \hline
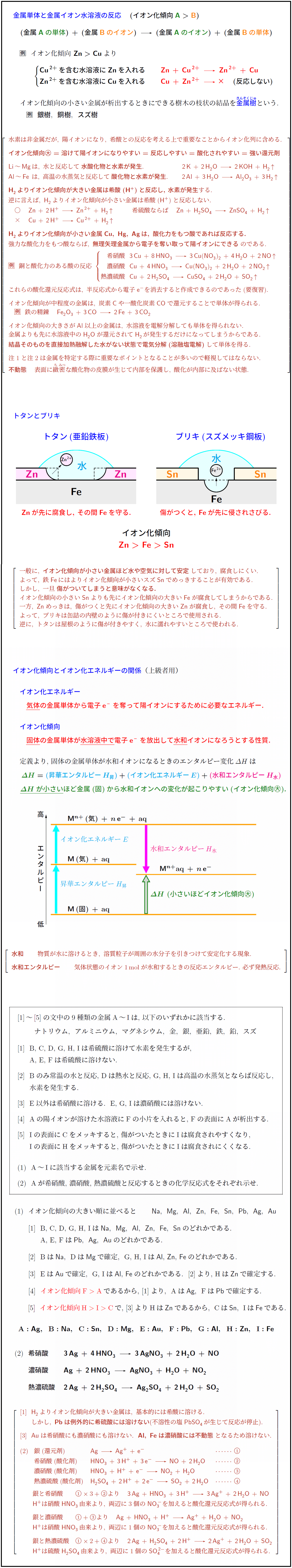
塩酸\ce{HCl}や希硫酸\ce{H2SO4}\,}}と反応はするが, 表面に\textbf{\textcolor{red}{不溶性の塩\ \ce{PbCl2}}, \textcolor{red}{\ce{PbSO4}}}を生じて被膜ができ,\反応が停止するため\textbf{溶けない.Fe}, \ce{Ni}, \ce{Al}}}は,\ \textbf{\textcolor{red}{\.{濃}硝酸には不動態}}となるため\textbf{溶けない.金属単体と金属イオン水溶液の反応}}
イオン化傾向の小さい金属が析出するときにできる樹木の枝状の結晶を\textbf{\textcolor{blue}{\rubytiny{金属樹}{きんぞくじゅ}}}という. 銀樹},\ \ \textbf{銅樹},\ \ \textbf{スズ樹} \\\\[1zh]
水素は非金属だが,\ 陽イオンになり,\ 希酸との反応を考える上で重要なことからイオン化列に含める. \\[1zh]
\bm{イオン化傾向\maru{大} = 溶けて陽イオンになりやすい = 反応しやすい = 酸化されやすい = 強い還元剤} \\[1zh]
\ce{Li}\,~\,\ce{Mg}\,は,\ 水と反応して\bm{水酸化物と水素が発生}. \ce{2K}\,+\,\ce{2H2O}\,\ce{->}\,\ce{2KOH}\,+\,\ce{H2 ^} \\[.4zh]
\ce{Al}\,~\,\ce{Fe}\hspace{.45zw}は,\ 高温の水蒸気と反応して\bm{酸化物と水素が発生}. \ce{2Al}\,+\,\ce{3H2O}\,\ce{->}\,\ce{Al2O3}\,+\,\ce{3H2 ^} \\[1zh]
\textbf{\ce{H2}\,よりイオン化傾向が大きい金属は希酸(\ce{H+})と反応し,\ 水素が発生}する. \\[.4zh]
逆に言えば,\ \ce{H2}\,よりイオン化傾向が小さい金属は希酸(\ce{H+})と反応しない. \\[.4zh]
\bm{\ce{H2}\,よりイオン化傾向が小さい金属\ce{Cu},\ \ce{Hg},\ \ce{Ag}\,は,\ 酸化力をもつ酸であれば反応する.} \\[.4zh]
強力な酸化力をもつ酸ならば,\ \bm{無理矢理金属から電子を奪い取って陽イオンにできる}のである. \\[.5zh]
\rei\ \ 銅と酸化力のある酸の反応\ \begin{cases}
希硝酸\ \ \ce{3Cu}\,+\,\ce{8HNO3}\,\ce{->}\,\ce{3Cu(NO3)2}\,+\,\ce{4H2O}\,+\,\ce{2NO ^} \\[.2zh]
濃硝酸\ \ \ce{Cu}\,+\,\ce{4HNO3}\,\ce{->}\,\ce{Cu(NO3)2}\,+\,\ce{2H2O}\,+\,\ce{2NO2 ^} \\[.2zh]
熱濃硫酸\ \ \ce{Cu}\,+\,\ce{2H2SO4}\,\ce{->}\,\ce{CuSO4}\,+\,\ce{2H2O}\,+\,\ce{SO2 ^}
\end{cases} \\\\[-.5zh]
これらの酸化還元反応式は,\ 半反応式から電子\ce{e-}を消去すると作成できるのであった(要復習). \\[1zh]
イオン化傾向が中程度の金属は,\ 炭素\ce{C}や一酸化炭素\ce{CO}で還元することで単体が得られる. \\[.2zh]
\rei\ \ 鉄の精錬 \ce{Fe2O3}\,+\,\ce{3CO}\,\ce{->}\,\ce{2Fe}\,+\,\ce{3CO2} \\[1zh]
イオン化傾向の大きさが\ce{Al}以上の金属は,\ 水溶液を電解分解しても単体を得られない. \\[.2zh]
金属よりも先に水溶液中の\ce{H2O}が還元されて\ce{H2}\,が発生するだけになってしまうからである. \\[.4zh]
\bm{結晶そのものを直接加熱融解した水がない状態で電気分解(溶融塩電解)}して単体を得る. \\[1zh]
注1と注2は金属を特定する際に重要なポイントとなることが多いので軽視してはならない. \\[.2zh]
\bm{不動態} 表面に\rubytiny{緻}{ち}\rubytiny{密}{みつ}な酸化物の皮膜が生じて内部を保護し,\ 酸化が内部に及ばない状態.
トタンとブリキトタン(亜鉛鉄板ブリキ(スズメッキ鋼板Zn}が先に腐食し,\ その間\ce{Fe}を守る.} \textcolor{red}{傷がつくと,\ \ce{Fe}が先に侵されさびる.}}} \\\\
一般に,\ \bm{イオン化傾向が小さい金属ほど水や空気に対して安定}しており,\ 腐食しにくい. \\[.2zh]
よって,\ 鉄\ce{Fe}\,にはよりイオン化傾向が小さいスズ\ce{Sn}でめっきすることが有効である. \\[.2zh]
しかし,\ 一旦\bm{傷がついてしまうと意味がなくなる.} \\[.2zh]
イオン化傾向の小さい\ce{Sn}よりも先にイオン化傾向の大きい\ce{Fe}が腐食してしまうからである. \\[.2zh]
一方,\ \ce{Zn}めっきは,\ 傷がつくと先にイオン化傾向の大きい\ce{Zn}が腐食し,\ その間\ce{Fe}を守る. \\[.2zh]
よって,\ ブリキは缶詰の内壁のように傷が付きにくいところで使用される. \\[.2zh]
逆に,\ トタンは屋根のように傷が付きやすく,\ 水に濡れやすいところで使われる.
イオン化傾向とイオン化エネルギーの関係}}(上級者用)気体}の金属単体から電子\ce{e-}を奪って陽イオンにするために必要なエネルギー.固体}の金属単体が\underline{水溶液中で}電子\ce{e-}を放出して\underline{水和}イオンになろうとする性質.}} \\\\
定義より,\ 固体の金属単体が水和イオンになるときのエンタルピー変化$\Delta H$は \\[.5zh]
(昇華エンタルピーH_昇)}+\textcolor{cyan}{(イオン化エネルギーE)}+\textcolor{magenta}{(水和エンタルピーH_水)\Delta H}$が小さい}ほど金属(固)から水和イオンへの変化が起こりやすい(イオン化傾向\maru{\textbf{大}}).}}} \\\\\\
\bm{水和} 物質が水に溶けるとき,\ 溶質粒子が周囲の水分子を引きつけて安定化する現象. \\[1zh]
\bm{水和エンタルピー} 気体状態のイオン1\,\text{mol}が水和するときの反応エンタルピー.\ 必ず発熱反応.
[1]\,~\,[5]の文中の9種類の金属A\,~\,Iは,\ 以下のいずれかに該当する. \\[.5zh]
ナトリウム,\ \ アルミニウム,\ \ マグネシウム,\ \ 金,\ \ 銀,\ \ 亜鉛,\ \ 鉄,\ \ 鉛,\ \ スズ \\[1zh]
\hspace{.5zw}[1]\ \ B,\ C,\ D,\ G,\ H,\ Iは希硫酸に溶けて水素を発生するが, \\[.2zh]
\hspace{.5zw}\phantom{[1]}\ \ A,\ E,\ Fは希硫酸に溶けない. \\[.8zh]
\hspace{.5zw}[2]\ \ Bのみ常温の水と反応,\ Dは熱水と反応,\ G,\ H,\ Iは高温の水蒸気とならば反応し, \\[.2zh]
\hspace{.5zw}\phantom{[1]}\ \ 水素を発生する. \\[.8zh]
\hspace{.5zw}[3]\ \ E以外は希硝酸に溶ける.\ \ E,\ G,\ Iは濃硝酸には溶けない. \\[.8zh]
\hspace{.5zw}[4]\ \ Aの陽イオンが溶けた水溶液にFの小片を入れると, Fの表面にAが析出する. \\[.8zh]
\hspace{.5zw}[5]\ \ Iの表面にCをメッキすると,\ 傷がついたときにIは腐食されやすくなり, \\[.2zh]
\hspace{.5zw}\phantom{[1]}\ \ Iの表面にHをメッキすると,\ 傷がついたときにIは腐食されにくくなる. \\\\
\hspace{.5zw}(1)\ \ A\,~\,Iに該当する金属を元素名で示せ. \\[.8zh]
\hspace{.5zw}(2)\ \ Aが希硝酸,\ 濃硝酸,\ 熱濃硫酸と反応するときの化学反応式をそれぞれ示せ. \\
H2}\,よりイオン化傾向が大きい金属は,\ 基本的には希酸に溶ける. \\[.4zh]
\phantom{[1]}\ \ しかし,\ \bm{\ce{Pb}は例外的に希硫酸には溶けない}(不溶性の塩\ce{PbSO4}\,が生じて反応が停止). \\[1zh]
[3]\ \ \ce{Au}は希硝酸にも濃硝酸にも溶けない.\ \ \bm{\ce{Al},\ \ce{Fe}は濃硝酸には不動態}となるため溶けない. H+}は硝酸\ce{HNO3}\,由来より,\ 両辺に3個の\ce{NO3^-}を加えると酸化還元反応式が得られる. \\[1zh]
\phantom{(1)}\ \ 銀と濃硝酸
\phantom{(1)}\ \ \ce{H+}は硝酸\ce{HNO3}\,由来より,\ 両辺に1個の\ce{NO3^-}を加えると酸化還元反応式が得られる. \\[1zh]
\phantom{(1)}\ \ 銀と熱濃硫酸
\phantom{(1)}\ \ \ce{H+}は硫酸\ce{H2SO4}\,由来より,\ 両辺に1個の\ce{SO4^2-}を加えると酸化還元反応式が得られる.

