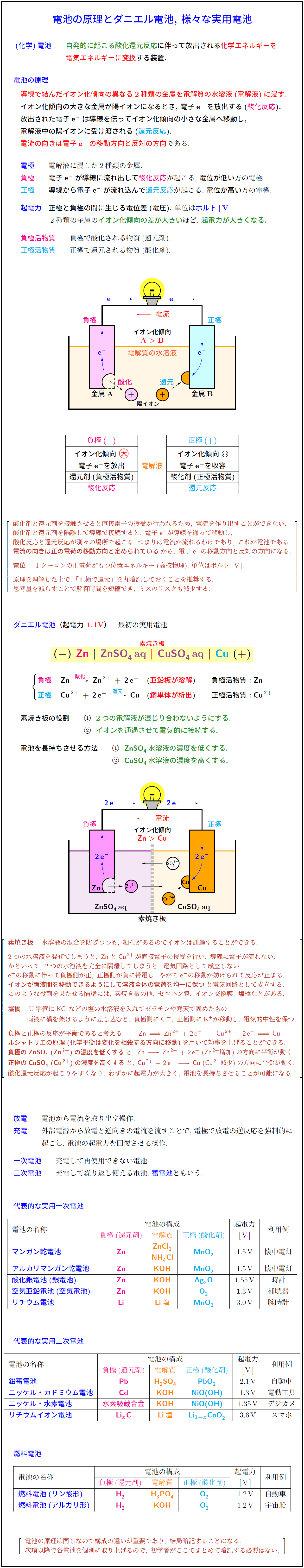
(化学)電池 自発的に起こる酸化還元反応に伴って放出される化学エネルギーを電気エネルギーに変換する装置.
電池の原理 導線で結んだイオン化傾向の異なる2種類の金属を電解質の水溶液(電解液)に浸す.
イオン化傾向の大きな金属が陽イオンになるとき, 電子e⁻を放出する(酸化反応).
放出された電子e⁻は導線を伝ってイオン化傾向の小さな金属へ移動し, 電解液中の陽イオンに受け渡される(還元反応).
電流の向きは電子e⁻の移動方向と反対の方向である.
電極 電解液に浸した2種類の金属.
負極 電子e⁻が導線に流れ出して酸化反応が起こる, 電位が低い方の電極.
正極 導線から電子e⁻が流れ込んで還元反応が起こる, 電位が高い方の電極.
起電力 正極と負極の間に生じる電位差(電圧). 単位はボルト[V].
2種類の金属のイオン化傾向の差が大きいほど, 起電力が大きくなる.
負極活物質 負極で酸化される物質(還元剤).
正極活物質 正極で還元される物質(酸化剤).
酸化剤と還元剤を接触させると直接電子の授受が行われるため, 電流を作り出すことができない.
酸化剤と還元剤を隔離して導線で接続すると, 電子e⁻が導線を通って移動し, 酸化反応と還元反応が別々の場所で起こる. つまりは電流が流れるわけであり, これが電池である.
電流の向きは正の電荷の移動方向と定められているから, 電子e⁻の移動方向と反対の方向になる.
電位 1クーロンの正電荷がもつ位置エネルギー(高校物理). 単位はボルト[V].
原理を理解した上で, 「正極で還元」を丸暗記しておくことを推奨する. 思考量を減らすことで解答時間を短縮でき, ミスのリスクも減少する.
ダニエル電池(起電力1.1V) 最初の実用電池
素焼き板
(−) Zn | ZnSO₄ aq | CuSO₄ aq | Cu (+)
負極 Zn → Zn²⁺ + 2e⁻ (亜鉛板が溶解) 負極活物質: Zn
正極 Cu²⁺ + 2e⁻ → Cu (銅単体が析出) 正極活物質: Cu²⁺
素焼き板の役割 ① 2つの電解液が混じり合わないようにする. ② イオンを通過させて電気的に接続する.
電池を長持ちさせる方法 ① ZnSO₄水溶液の濃度を低くする. ② CuSO₄水溶液の濃度を高くする.
素焼き板 水溶液の混合を防ぎつつも, 細孔があるのでイオンは通過することができる.
2つの水溶液を混ぜてしまうと, ZnとCu²⁺が直接電子の授受を行い, 導線に電子が流れない.
かといって, 2つの水溶液を完全に隔離してしまうと, 電気回路として成立しない.
電子e⁻の移動に伴って負極側が正, 正極側が負に帯電し, やがて電子e⁻の移動が妨げられて反応が止まる.
イオンが両液間を移動できるようにして溶液全体の電荷を均一に保つと電気回路として成立する.
このような役割を果たせる隔壁には, 素焼き板の他, セロハン膜, イオン交換膜, 塩橋などがある.
塩橋 U字管にKClなどの塩の水溶液を入れてゼラチンや寒天で固めたもの. 両液に橋を架けるように差し込むと, 負極側にCl⁻, 正極側にK⁺が移動し, 電気的中性を保つ.
負極と正極の反応が平衡であると考える. Zn ⇄ Zn²⁺ + 2e⁻ Cu²⁺ + 2e⁻ ⇄ Cu
ルシャトリエの原理(化学平衡は変化を相殺する方向に移動)を用いて効率を上げることができる.
負極のZnSO₄(Zn²⁺)の濃度を低くすると, Zn → Zn²⁺ + 2e⁻(Zn²⁺増加)の方向に平衡が動く.
正極のCuSO₄(Cu²⁺)の濃度を高くすると, Cu²⁺ + 2e⁻ → Cu(Cu²⁺減少)の方向に平衡が動く.
酸化還元反応が起こりやすくなり, わずかに起電力が大きく, 電池を長持ちさせることが可能になる.
放電 電池から電流を取り出す操作.
充電 外部電源から放電と逆向きの電流を流すことで, 電極で放電の逆反応を強制的に起こし, 電池の起電力を回復させる操作.
一次電池 充電して再使用できない電池.
二次電池 充電して繰り返し使える電池. 蓄電池ともいう.
代表的な実用一次電池
マンガン乾電池 負極 Zn 電解質 ZnCl₂・NH₄Cl 正極 MnO₂ 起電力1.5V 懐中電灯
アルカリマンガン乾電池 負極 Zn 電解質 KOH 正極 MnO₂ 1.5V 懐中電灯
酸化銀電池(銀電池) 負極 Zn 電解質 KOH 正極 Ag₂O 1.55V 時計
空気亜鉛電池(空気電池) 負極 Zn 電解質 KOH 正極 O₂ 1.3V 補聴器
リチウム電池 負極 Li 電解質 Li塩 正極 MnO₂ 3.0V 腕時計
代表的な実用二次電池
鉛蓄電池 負極 Pb 電解質 H₂SO₄ 正極 PbO₂ 2.1V 自動車
ニッケル・カドミウム電池 負極 Cd 電解質 KOH 正極 NiO(OH) 1.3V 電動工具
ニッケル・水素電池 負極 水素吸蔵合金 電解質 KOH 正極 NiO(OH) 1.35V デジカメ
リチウムイオン電池 負極 LiₓC 電解質 Li塩 正極 Li₁₋ₓCoO₂ 3.6V スマホ
燃料電池
燃料電池(リン酸形) 負極 H₂ 電解質 H₃PO₄ 正極 O₂ 1.2V 自動車
燃料電池(アルカリ形) 負極 H₂ 電解質 KOH 正極 O₂ 1.2V 宇宙船
電池の原理は同じなので構成の違いが重要であり, 結局暗記することになる.
次項以降で各電池を個別に取り上げるので, 初学者がここでまとめて暗記する必要はない.

