レドックスフロー電池
電池の分類
[ 表 ]
& 活物質を内蔵 & 活物質を外部から供給
充電不可 & 一次電池 & 燃料電池
充電可能 & 二次電池 & レドックスフロー電池
レドックスフロー電池
電解液の循環(flow)でイオンの酸化還元(redox)反応を起こして放充電する二次電池.
複数の酸化数をとる金属元素の可逆的な反応を2つ組み合わせた構造をもつ.
現在, 第5族遷移金属元素バナジウムVを用いたものが実用化されている.
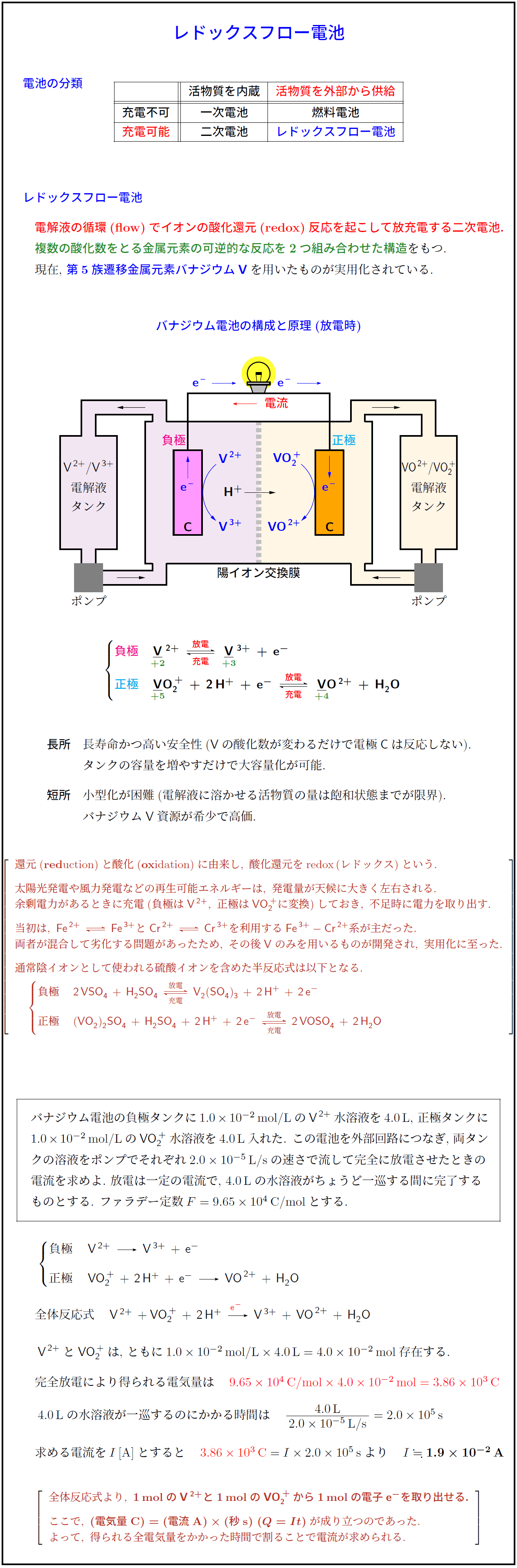
バナジウム電池の構成と原理(放電時)
[図]
負極 V²⁺ ⇄(放電/充電) V³⁺ + e⁻
正極 VO₂⁺ + 2H⁺ + e⁻ ⇄(放電/充電) VO²⁺ + H₂O
長所 長寿命かつ高い安全性(Vの酸化数が変わるだけで電極Cは反応しない).
タンクの容量を増やすだけで大容量化が可能.
短所 小型化が困難(電解液に溶かせる活物質の量は飽和状態までが限界).
バナジウムV資源が希少で高価.
[補足]
還元(reduction)と酸化(oxidation)に由来し, 酸化還元をredox(レドックス)という.
太陽光発電や風力発電などの再生可能エネルギーは, 発電量が天候に大きく左右される.
余剰電力があるときに充電(負極はV²⁺, 正極はVO₂⁺に変換)しておき, 不足時に電力を取り出す.
当初は, Fe²⁺ ⇄ Fe³⁺ と Cr²⁺ ⇄ Cr³⁺ を利用する Fe³⁺-Cr²⁺ 系が主だった.
両者が混合して劣化する問題があったため, その後Vのみを用いるものが開発され, 実用化に至った.
通常陰イオンとして使われる硫酸イオンを含めた半反応式は以下となる.
負極 2VSO₄ + H₂SO₄ ⇄(放電/充電) V₂(SO₄)₃ + 2H⁺ + 2e⁻
正極 (VO₂)₂SO₄ + H₂SO₄ + 2H⁺ + 2e⁻ ⇄(放電/充電) 2VOSO₄ + 2H₂O
[問題]
バナジウム電池の負極タンクに 1.0×10⁻² mol/L の V²⁺ 水溶液を 4.0 L, 正極タンクに 1.0×10⁻² mol/L の VO₂⁺ 水溶液を 4.0 L 入れた. この電池を外部回路につなぎ, 両タンクの溶液をポンプでそれぞれ 2.0×10⁻⁵ L/s の速さで流して完全に放電させたときの電流を求めよ. 放電は一定の電流で, 4.0 L の水溶液がちょうど一巡する間に完了するものとする. ファラデー定数 F=9.65×10⁴ C/mol とする.
負極 V²⁺ → V³⁺ + e⁻
正極 VO₂⁺ + 2H⁺ + e⁻ → VO²⁺ + H₂O
全体反応式 V²⁺ + VO₂⁺ + 2H⁺ → V³⁺ + VO²⁺ + H₂O
V²⁺ と VO₂⁺ は, ともに 1.0×10⁻² mol/L × 4.0 L = 4.0×10⁻² mol 存在する.
完全放電により得られる電気量は 9.65×10⁴ C/mol × 4.0×10⁻² mol = 3.86×10³ C
4.0 L の水溶液が一巡するのにかかる時間は 4.0 L / (2.0×10⁻⁵ L/s) = 2.0×10⁵ s
求める電流を I [A] とすると 3.86×10³ C = I × 2.0×10⁵ s より I ≈ 1.9×10⁻² A
[メモ]
全体反応式より, 1 mol の V²⁺ と 1 mol の VO₂⁺ から 1 mol の電子 e⁻ を取り出せる.
(電気量 C)=(電流 A)×(秒 s) (Q=It) が成り立つのであった.
よって, 得られる全電気量をかかった時間で割ることで電流が求められる.

