(化学)電池} 自発的に}起こる酸化還元反応}に伴って放出される\textcolor{red}{化学エネルギーを \\[.2zh]
\phantom{ (化学)電池 }電気エネルギーに変換}する装置.電池の原理} \\[.5zh]
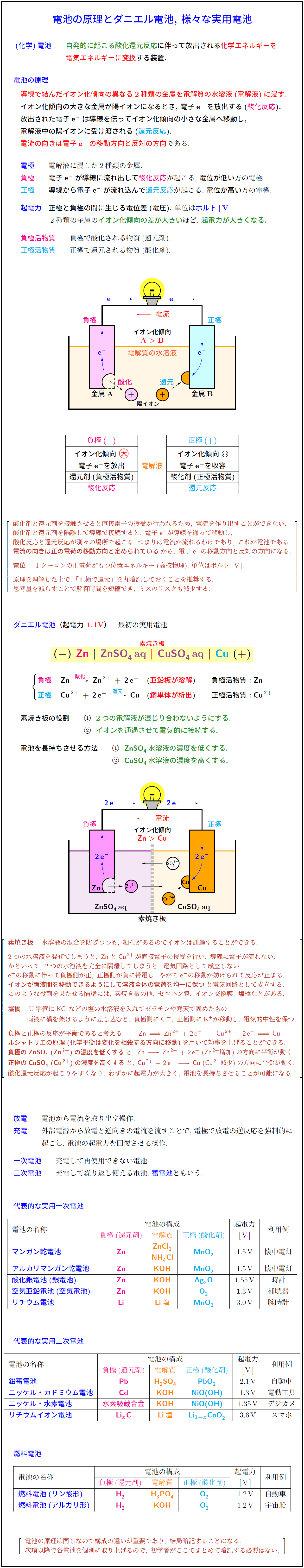
\textcolor{red}{導線で結んだイオン化傾向の異なる2種類の金属を電解質の水溶液(電解液)に浸す.}} \\[.2zh]
\textbf{イオン化傾向の大きな金属が陽イオンになるとき,\ 電子\ce{e-}を放出する(\textcolor{magenta}{酸化反応}). \\[.2zh]
放出された電子\ce{e-}は導線を伝ってイオン化傾向の小さな金属へ移動し, \\[.2zh]
電解液中の陽イオンに受け渡される(\textcolor{cyan}{還元反応}).} \\[.2zh]
\textbf{\textcolor{red}{電流の向きは電子\ce{e-}の移動方向と反対の方向}}である. \\\\
\textbf{\textcolor{blue}{電極}} 電解液に浸した2種類の金属. \\[.2zh]
\textbf{\textcolor{magenta}{負極}} \textbf{電子\ce{e-}が導線に流れ出して\textcolor{magenta}{酸化反応}}が起こる, \textbf{電位が低い}方の電極. \\[.2zh]
\textbf{\textcolor{cyan}{正極}} \textbf{導線から電子\ce{e-}が流れ込んで\textcolor{cyan}{還元反応}}が起こる,\ \textbf{電位が高い}方の電極. \\[1zh]
\textbf{\textcolor{blue}{起電力}} \textbf{正極と負極の間に生じる電位差(電圧).}\ 単位は\textbf{\textcolor{blue}{ボルト[\,V\,]}}. \\[.2zh]
2種類の金属の\textbf{\textcolor{forestgreen}{イオン化傾向の差が大きい}}ほど, \textbf{\textcolor{forestgreen}{起電力が大きくなる.}} \\[1zh]
\textbf{\textcolor{magenta}{負極活物質}} 負極で酸化される物質(還元剤). \\[.2zh]
\textbf{\textcolor{cyan}{正極活物質}} 正極で還元される物質(酸化剤). \\[1zh]
イオン化傾向\ \raisebox{-.1zh}{{\Large \textcolor{red}{\maru{大}}}} & & イオン化傾向\ {\small \maru{小}} \\
電子\ce{e-}を放出 & \textcolor{orange}{電解液} & 電子\ce{e-}を収容 還元剤(負極活物質) & & 酸化剤(正極活物質) 酸化反応} & & \textcolor{cyan}{還元反応}酸化剤と還元剤を接触させると直接電子の授受が行われるため,\ 電流を作り出すことができない. \\[.2zh]
酸化剤と還元剤を隔離して導線で接続すると,\ 電子\ce{e-}が導線を通って移動し,\ \\[.2zh]
酸化反応と還元反応が別々の場所で起こる.\ つまりは電流が流れるわけであり,\ これが電池である. \\[.2zh]
\bm{電流の向きは正の電荷の移動方向と定められている}から,\ 電子\ce{e-}の移動方向と反対の方向になる. \\[1zh]
\bm{電位} 1クーロンの正電荷がもつ位置エネルギー(高校物理).\ 単位はボルト\text{[\,V\,]}. \\[1zh]
原理を理解した上で,\ 「正極で還元」を丸暗記しておくことを推奨する. \\[.2zh]
思考量を減らすことで解答時間を短縮でき,\ ミスのリスクも減少する.
ダニエル電池}(起電力 \textcolor{red}{1.1V})} 最初の実用電池 \\\\[-.5zh]
素焼き板}}}} \\[-.3zh]
負極}亜鉛板が溶解}) 負極活物質:\ce{Zn} \\[.4zh]
銅単体が析出}) 正極活物質
\textbf{素焼き板の役割2つの電解液が混じり合わないようにする.}イオンを通過させて電気的に接続する.}} \\[1zh]
\textbf{電池を長持ちさせる方法} ZnSO4}\,水溶液の濃度を\underline{低く}する.}CuSO4}\,水溶液の濃度を\underline{高く}する. \bm{素焼き板} 水溶液の混合を防ぎつつも,\ 細孔があるのでイオンは通過することができる. \\[1zh]
2つの水溶液を混ぜてしまうと,\ \ce{Zn}と\ce{Cu^2+}\,が直接電子の授受を行い,\ 導線に電子が流れない. \\[.2zh]
かといって,\ 2つの水溶液を完全に隔離してしまうと,\ 電気回路として成立しない. \\[.2zh]
\ce{e-}の移動に伴って負極側が正,\ 正極側が負に帯電し,\ やがて\ce{e-}の移動が妨げられて反応が止まる. \\[.2zh]
\bm{イオンが両液間を移動できるようにして溶液全体の電荷を均一に保つ}と電気回路として成立する. \\[.2zh]
このような役割を果たせる隔壁には,\ 素焼き板の他,\ セロハン膜,\ イオン交換膜,\ 塩橋などがある. \\[1zh]
塩橋 \text U字管に\ce{KCl}などの\dot{塩}の水溶液を入れてゼラチンや寒天で固めたもの. \\[.2zh]
両液に\dot{橋}を架けるように差し込むと,\ 負極側に\ce{Cl-},\ 正極側に\ce{K+}が移動し,\ 電気的中性を保つ. \\[1zh]
負極と正極の反応が平衡であると考える.
\bm{ルシャトリエの原理(化学平衡は変化を相殺する方向に移動)}を用いて効率を上げることができる. \\[.2zh]
負極の\ce{ZnSO4}\ (\ce{Zn^2+})の濃度を\underline{低く}する}と,\ \ce{Zn}\,\ce{->}\,\ce{Zn^2+}\,+\,\ce{2e-}\ (\ce{Zn^2+}増加)の方向に平衡が動く.正極の\ce{CuSO4}\ (\ce{Cu^2+})の濃度を\underline{高く}する}と,\ \ce{Cu^2+}\,+\,\ce{2e-}\,\ce{->}\,\ce{Cu}\ (\ce{Cu^2+}減少)の方向に平衡が動く.$}} \\[.4zh]
酸化還元反応が起こりやすくなり,\ わずかに起電力が大きく,\ 電池を長持ちさせることが可能になる.
放電}} 電池から電流を取り出す操作. \\[.2zh]
\textbf{\textcolor{blue}{充電}} 外部電源から放電と逆向きの電流を流すことで,\ 電極で放電の逆反応を強制的に \\[.2zh]
起こし,\ 電池の起電力を回復させる操作. \\[1zh]
\textbf{\textcolor{blue}{一次電池}} 充電して再使用できない電池. \\[.2zh]
\textbf{\textcolor{blue}{二次電池}} 充電して繰り返し使える電池.\ \textbf{\textcolor{blue}{蓄電池}}ともいう. \\\\\\
\textbf{\textcolor{blue}{代表的な実用一次電池}} \\[1zh]
電池の名称} & \multicolumn{3}{c|}{電池の構成} & 起電力 & \multirow{2}*{利用例} \\\cline{2-4}
& \textcolor{magenta}{負極(還元剤)} & \textcolor{orange}{電解質} & \textcolor{cyan}{正極(酸化剤)} マンガン乾電池MnO21.5\,V}懐中電灯} \\
NH4Cl}アルカリマンガン乾電池}}{KOH}}} & \textbf{\textcolor{cyan}{\ce{MnO2}}} & 1.5\,V & 懐中電灯 \\\hline
酸化銀電池(銀電池)}} KOHAg2O}}} & 1.55\,V & 時計 空気亜鉛電池(空気電池)}KOHO2}}} & 1.3\,V & 補聴器 リチウム電池}} &{Li}}} & \textbf{\textcolor{orange}{\ce{Li}塩}} MnO2}}} & 3.0\,V & 腕時計 \\
代表的な実用二次電池電池の名称電池の構成} & 起電力
& \textcolor{magenta}{負極(還元剤)} & \textcolor{orange}{電解質} & \textcolor{cyan}{正極(酸化剤)} & [\,V\,] & \\\hline
\textbf{\textcolor{blue}{鉛蓄電池}} & \textbf{\textcolor{magenta}{\ce{Pb}}} & \textbf{\textcolor{orange}{\ce{H2SO4}}} & \textbf{\textcolor{cyan}{\ce{PbO2}}} & 2.1\,V & 自動車 \\\hline
\textbf{\textcolor{blue}{ニッケル・カドミウム電池}} & \textbf{\textcolor{magenta}{\ce{Cd}}} & \textbf{\textcolor{orange}{\ce{KOH}}} & \textbf{\textcolor{cyan}{\ce{NiO(OH)}}} & 1.3\,V & 電動工具 \\\hline
\textbf{\textcolor{blue}{ニッケル・水素電池}} & \textbf{\textcolor{magenta}{水素吸蔵合金}} & \textbf{\textcolor{orange}{\ce{KOH}}} & \textbf{\textcolor{cyan}{\ce{NiO(OH)}}} & 1.35\,V & デジカメ \\\hline
\textbf{\textcolor{blue}{リチウムイオン電池}} & \textbf{\textcolor{magenta}{\ce{Li}$\bm{_x}$\ce{C}}} & \textbf{\textcolor{orange}{\ce{Li}塩}} & \textbf{\textcolor{cyan}{\ce{Li}$\bm{_{1-x}}$\ce{CoO2}}} & 3.6\,V & スマホ \\
{燃料電池電池の名称}電池の構成}
& \textcolor{magenta}{負極(還元剤)} & \textcolor{orange}{電解質} & \textcolor{cyan}{正極(酸化剤)} & [\,V\,] & \\\hline
\textbf{\textcolor{blue}{燃料電池(リン酸形)}}H3PO4 1.2\,V & 自動車 \\\hline
\textbf{\textcolor{blue}{燃料電池(アルカリ形)}} & 1.2\,V & 宇宙船
電池の原理は同じなので構成の違いが重要であり,\ 結局暗記することになる. \\[.2zh]
次項以降で各電池を個別に取り上げるので,\ 初学者がここでまとめて暗記する必要はない.

