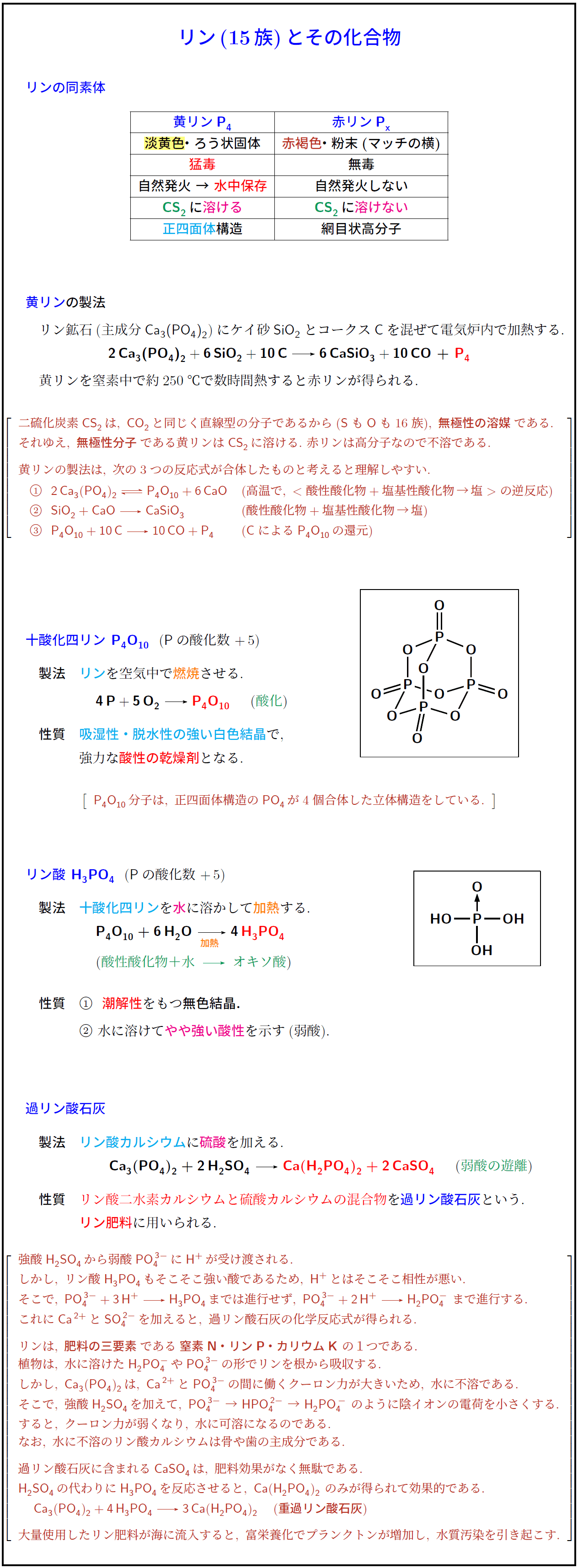
リンの同素体黄リン \ce{P4}} & \textcolor{blue}{赤リン \ce{P_x}}淡黄色}}・ろう状固体 & \textcolor[named]{BrickRed}{赤褐色}・粉末(マッチの横) \\ \hline
\textcolor{red}{猛毒} & 無毒 \\ \hline
自然発火\ →\ \textcolor{red}{水中保存} & 自然発火しない \\ \hline
\textcolor[named]{ForestGreen}{\ce{CS2}}\,に\textcolor{magenta}{溶ける} & \textcolor[named]{ForestGreen}{\ce{CS2}}\,に\textcolor{magenta}{溶けない} \\ \hline
\textcolor{cyan}{正四面体}構造 & 網目状高分子 \\\hline
黄リン}の製法} \\[.5zh]
リン鉱石(主成分\ce{Ca3(PO4)2})にケイ砂\ce{SiO2}とコークス\ce{C}を混ぜて電気炉内で加熱する. \\[.2zh]
\centerline{\textbf{\ce{2Ca3(PO4)2 + 6SiO2 + 10C -> 6CaSiO3 + 10CO} + \textcolor{red}{\ce{P4}}}} \\[.5zh]
黄リンを窒素中で約250℃で数時間熱すると赤リンが得られる
二硫化炭素\ce{CS2}\,は,\ \ce{CO2}\,と同じく直線型の分子であるから(\ce{S}も\ce{O}も16族),\ \bm{無極性の溶媒}である. \\[.4zh]
それゆえ,\ \bm{無極性分子}である黄リンは\ce{CS2}\,に溶ける.\ 赤リンは高分子なので不溶である. \\[1zh]
黄リンの製法は,\ 次の3つの反応式が合体したものと考えると理解しやすい. \\[.5zh]
\begin{array}{ll}
\ \maru1\ \ \ce{2Ca3(PO4)2 <=> P4O10 + 6CaO} & (高温で,\ <酸性酸化物+塩基性酸化物\,→\,塩>の逆反応) \\[.4zh]
\ \maru2\ \ \ce{SiO2 + CaO -> CaSiO3} & (酸性酸化物+塩基性酸化物\,→\,塩) \\[.4zh]
\ \maru3\ \ \ce{P4O10 + 10C -> 10CO + P4} & (\ce{C}による\ce{P4O10}\,の還元)
十酸化四リン \ce{P_4O_{10}}}}\ \ (\ce{P}の酸化数\ $+\,5$) \\[1zh]
\textbf{製法} \textbf{\textcolor{cyan}{リン}}を空気中で\textbf{\textcolor{orange}{燃焼}}させる. \\[.5zh]
\textbf{\ce{4P + 5O2 -> }\textcolor{red}{\ce{P4O_{10}}}} (\textcolor[named]{ForestGreen}{酸化}) \\[1zh]
\textbf{性質} \textbf{\textcolor{cyan}{吸湿性・脱水性の強い白色結晶}}で, \\[.2zh]
強力な\textbf{\textcolor{red}{酸性の乾燥剤}}となる. \\\\
P4O10}\,分子は,\ 正四面体構造の\ce{PO4}\,が4個合体した立体構造をしている.
リン酸 \ce{H_3PO_4}}}\ \ (\ce{P}の酸化数\ $+\,5$) \\[1zh]
\textbf{製法} \textbf{\textcolor{cyan}{十酸化四リン}}を\textbf{\textcolor{magenta}{水}}に溶かして\textbf{\textcolor{orange}{加熱}}する. \\[.2zh]
$\bm{\ce{P4O_{10} + 6H2O ->[][\textcolor{orange}{加熱}] 4}\textcolor{red}{\ce{H3PO4}}}$ \\[.2zh]
(\textcolor[named]{ForestGreen}{酸性酸化物+水\ce{->}オキソ酸}) \\\\
\textbf{性質} \maru1\ \ \textbf{\textcolor{red}{潮解性}}をもつ\textbf{無色結晶.} \\[.5zh]
\maru2\ 水に溶けて\textbf{\textcolor{magenta}{やや強い酸性}}を示す(弱酸). \\\\\\
過リン酸石灰}} \\[1zh]
\textbf{製法} \textbf{\textcolor{cyan}{リン酸カルシウム}}に\textbf{\textcolor{magenta}{硫酸}}を加える. \\[.2zh]
$\bm{\ce{Ca3(PO4)2 + 2H2SO4 ->} \textcolor{red}{\ce{Ca(H2PO4)2 + 2CaSO4}}}$ 弱酸の遊離}) \\[1zh]
\textbf{性質} \textcolor{red}{リン酸二水素カルシウムと硫酸カルシウムの混合物}を\textbf{\textcolor{blue}{過リン酸石灰}}という. \\[.2zh]
\textbf{\textcolor{red}{リン肥料}}に用いられる
強酸\ce{H2SO4}\,から弱酸\ce{PO4^3-}\,に\ce{H+}\,が受け渡される. \\[.4zh]
しかし,\ リン酸\ce{H3PO4}\,もそこそこ強い酸であるため,\ \ce{H+}\,とはそこそこ相性が悪い. \\[.4zh]
そこで,\ \ce{PO4^3- + 3H+ -> H3PO4}\,までは進行せず,\ \ce{PO4^3- + 2H+ -> H2PO4-}\ まで進行する. \\[.4zh]
これに\ce{Ca^2+}\,と\ce{SO4^2-}\,を加えると,\ 過リン酸石灰の化学反応式が得られる. \\[1zh]
リンは,\ \bm{肥料の三要素}である\bm{窒素\ce{N}・リン\ce{P}・カリウム\ce{K}}\ の1つである. \\[.2zh]
植物は,\ 水に溶けた\ce{H2PO4-}\,や\ce{PO4^3-}\,の形でリンを根から吸収する. \\[.4zh]
しかし,\ \ce{Ca3(PO4)2}\,は,\ \ce{Ca^2+}\,と\ce{PO4^3-}\,の間に働くクーロン力が大きいため,\ 水に不溶である. \\[.4zh]
そこで,\ 強酸\ce{H2SO4}\,を加えて,\ \ce{PO4^3-}\ →\ \ce{HPO4^2-}\ →\ \ce{H2PO4^-}\ のように陰イオンの電荷を小さくする. \\[.4zh]
すると,\ クーロン力が弱くなり,\ 水に可溶になるのである. \\[.2zh]
なお,\ 水に不溶のリン酸カルシウムは骨や歯の主成分である. \\[1zh]
過リン酸石灰に含まれる\ce{CaSO4}\,は,\ 肥料効果がなく無駄である. \\[.4zh]
\ce{H2SO4}\,の代わりに\ce{H3PO4}\,を反応させると,\ \ce{Ca(H2PO4)2}\ のみが得られて効果的である. \\[.4zh]
\ce{Ca3(PO4)2 + 4H3PO4 -> 3Ca(H2PO4)2} (\bm{重過リン酸石灰}) \\[1zh]
大量使用したリン肥料が海に流入すると,\ 富栄養化でプランクトンが増加し,\ 水質汚染を引き起こす.

