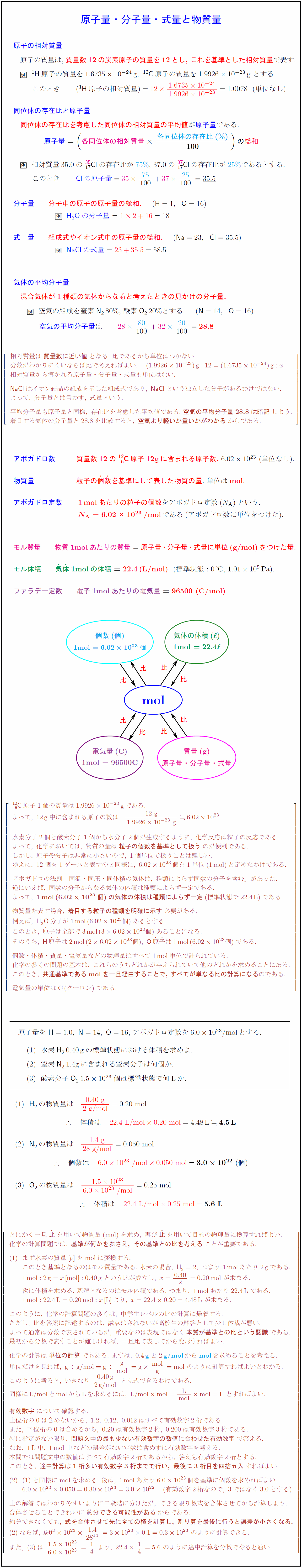
原子の相対質量 原子の質量は,\ 質量数12の炭素原子の質量を12とし, これを基準とした相対質量で表す. ${^1H}原子の質量を1.673510^{-24}g},\ {^{12}C}原子の質量を1.992610^{-23}g}\ とする.$ このとき $({^1H}原子の相対質量)=12{1.673510^{-24{1.992610^{-23}=1.0078$(単位なし) 同位体の存在比と原子量 同位体の存在比を考慮した同位体の相対質量の平均値が原子量である. { $原子量}=( 各同位体の相対質量}{各同位体の存在比(\%){100}) の総和}$ 相対質量35.0の{^{35_{17}Cl}の存在比が75\%},\ 37.0の{^{37_{17}Cl}の存在比が25\%}であるとする. このとき ${Cl}の原子量}=35}{75{100}+37}{25{100}=35.5}$ 分子量 分子中の原子の原子量の総和. (${H}=1,{O}=16$) H₂Oの分子量} = $12+16}=18$ 式 量 組成式やイオン式中の原子量の総和. (${Na}=23,{Cl}=35.5$) {NaCl}の式量} = $23+35.5}=58.5$ 気体の平均分子量 混合気体が1種類の気体からなると考えたときの見かけの分子量.\ 空気の組成を窒素{N₂}80\%,\ 酸素O₂20\%とする. (${N}=14,{O}=16$) 空気の平均分子量は 相対質量は{質量数に近い値}となる.\ 比であるから単位はつかない. 分数がわかりにくいならば比で考えればよい. 1.992610^{-23}g}:12=1.673510^{-24}g}:x 相対質量から導かれる原子量・分子量・式量も単位はない. {NaCl}はイオン結晶の組成を示した組成式であり,\ {NaCl}という独立した分子があるわけではない. よって,\ 分子量とは言わず,\ 式量という. 平均分子量も原子量と同様,\ 存在比を考慮した平均値である.\ {空気の平均分子量28.8は暗記}しよう. 着目する気体の分子量と28.8を比較すると,\ {空気より軽いか重いかがわかる}からである. アボガドロ数 質量数12の{^{12}_6C}原子12gに含まれる原子数.\ $6.0210^{23}\ (単位なし).$ 物質量 粒子の{個}{数}を基準にして表した物質の量.\ 単位はmol. アボガドロ定数 1molあたりの粒子の個数をアボガドロ定数($N_{A}$)という. =6.02×10^{23}/mol$である(アボガドロ数に単位をつけた). {モル質量 物質1molあたりの質量原子量・分子量・式量に単位(g/mol)をつけた量. モル体積 {気}{体}1molの体積 =} 22.4(L/mol})}$(標準状態:0℃, $1.0110⁵$Pa). 質量(g)原子量・分子量・式量電気量(C)}{密度 {^{12}_6C}原子1個の質量は1.992610^{-23}g}である. よって,\ 12g}中に含まれる原子の数は {12\ g{1.992610^{-23}\ g6.0210^{23} 水素分子2個と酸素分子1個から水分子2個が生成するように,\ 化学反応は粒子の反応である. よって,\ 化学においては,\ 物質の量は{粒子の個数を基準として扱う}のが便利である. しかし,\ 原子や分子は非常に小さいので,\ 1個単位で扱うことは難しい. ゆえに,\ 12個を1ダースと表すのと同様に,\ 6.0210^{23}個を1単位(1mol})と定めたわけである. アボガドロの法則「同温・同圧・同体積の気体は,\ 種類によらず同数の分子を含む」があった. 逆にいえば,\ 同数の分子からなる気体の体積は種類によらず一定である. よって,\ 1mol}(${6.0210^{23$個)の気体の体積は種類によらず一定}(標準状態で22.4L})である. 物質量を表す場合,\ {着目する粒子の種類を明確に示す}必要がある. 例えば,\ H₂O分}子}が1mol}(6.0210^{23}個)あるとする. このとき,\ 原}子}は全部で3mol}(36.0210^{23}個)あることになる. そのうち,\ {H}原}子}は2mol}(26.0210^{23}個),\ {O}原}子}は1mol}(6.0210^{23}個)である. 個数・体積・質量・電気量などの物理量はすべて1mol}単位で計られている. 化学の多くの問題の基本は,\ これらのうちどれかが与えられていて他のどれかを求めることにある. このとき,\ 共通基準であるmol}を一旦経由することで,\ すべてが単なる比の計算になる}のである. 原子量を\ ${H}=1.0,\ {N}=14,\ {O}=16$,\ アボガドロ定数を$6.010^{23}$/molとする. 水素H₂0.40gの標準状態における体積を求めよ. 窒素{N₂}1.4gに含まれる窒素分子は何個か. 酸素分子O₂$1.510^{23}$個は標準状態で何Lか. とにかく一旦{比を用いて物質量(mol})を求め,\ 再び{比を用いて目的の物理量に換算すればよい. 化学の計算問題では,\ {基準が何かをおさえ,\ その基準との比を考える}ことが重要である. まず水素の質量[g}]をmol}に変換する. このとき基準となるのはモル質量である.\ 水素の場合,\ H₂=2,\ つまり\ 1mol}あたり2g}である. 次に体積を求める.\ 基準となるのはモル体積である.\ つまり,\ 1mol}あたり22.4L}である. このように,\ 化学の計算問題の多くは,\ 中学生レベルの比の計算に帰着する. ただし,\ 比を答案に記述するのは,\ 減点はされないが高校生の解答として少し体裁が悪い. よって通常は分数で表されているが,\ 重要なのは表現ではなく{本質が基準との比という認識}である. 最初から分数で表すことが難しければ,\ 一旦比で表してから変形すればよい. 化学の計算は{単位の計算}でもある.\ 単位だけを見れば,\ のように計算すればよいことがわかる. このように考ると,\ いきなり\ と立式できるわけである. {有効数字}について確認する. 上位桁の0は含めないから,\ 1.2,\ 0.12,\ 0.012はすべて有効数字2桁である. また,\ 下位桁の0は含めるから,\ 0.20は有効数字2桁,\ 0.200は有効数字3桁である. 特に指定がない限り,\ {問題文中の最も少ない有効数字の数値に合わせた有効数字}で答える. なお,\ 1L}中,\ 1mol}中などの誤差がない定数は含めずに有効数字を考える. 本問では問題文中の数値はすべて有効数字2桁であるから,\ 答えも有効数字2桁とする. このとき,\ {途中計算は1桁多い有効数字3桁までで行い,\ 最後に3桁目を四捨五入}すればよい. と同様にmol}を求める.\ 後は,\ 1mol}あたり6.010^{23}個を基準に個数を求めればよい. 有効数字2桁なので,\ 3ではなく3.0とする) 上の解答ではわかりやすいように二段階に分けたが,\ できる限り数式を合体させてから計算しよう. 合体させることできれいに{約分できる可能性がある}からである. 約分できなくても,\ {式を合体させて先に全ての積を計算し,\ 割り算を最後に行うと誤差が小さくなる.} のように途中計算を分数でやると速い.

