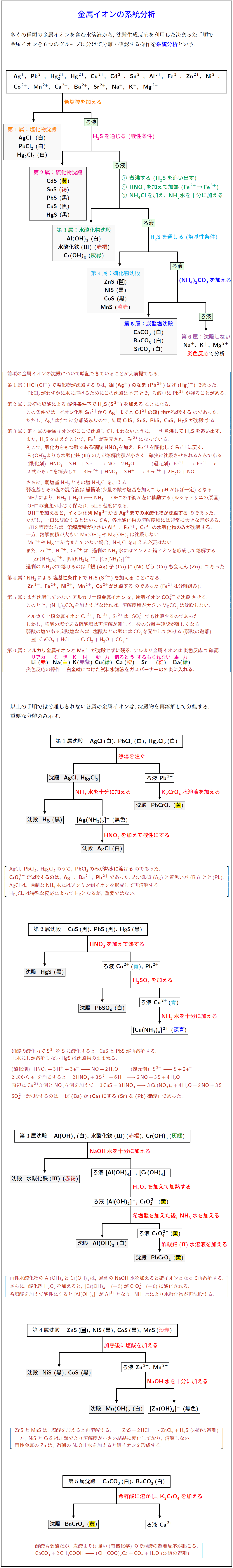
多くの種類の金属イオンを含む水溶液から,\ 沈殿生成反応を利用した決まった手順で \\[.2zh]
金属イオンを6つのグループに分けて分離・確認する操作を\textbf{\textcolor{blue}{系統分析}}という. \\\\\\
熱水希塩酸を加える}}}
H2S}を通じる (酸性条件)}}}
煮沸する\ (\ce{H2S}を追い出す)}}}
HNO3}を加えて加熱\ (\ce{Fe^2+}\,→\,\ce{Fe^3+})}}}
NH4Cl}を加え,\ \ce{NH3}水を十分に加える}$}}}
H2S}を通じる (塩基性条件)}}}
NH4)2CO3}を加える}}}
第1属:塩化物沈殿} \\
\ce{AgCl}\ \ (白) \\
\ce{PbCl2}\ (白) \\
\ce{Hg2Cl2}\ (白)
第2属:硫化物沈殿} \\
\ce{CdS}\黄}}) \\
\ce{SnS}褐}) \\
\ce{PbS}\ (黒) \\
\ce{CuS}\ (黒) \\
\ce{HgS}\ (黒)
第3属:水酸化物沈殿} \\
\ce{Al(OH)3}\ (白) \\
水酸化赤褐}) \\
\ce{Cr(OH)3}\ (\textcolor[named]{ForestGreen}{灰緑})
第4属:硫化物沈殿淡赤第5属:炭酸塩沈殿} \\
\ce{CaCO3}\ (白) \\
\ce{BaCO3}\ (白) \\
\ce{SrCO3}\ (白)
第6属:沈殿しない} \\
\ce{Na+},\ \ce{K+},\ \ce{Mg^2+} \\
\textcolor{red}{炎色反応}で分析
前項の金属イオンの沈殿について暗記できていることが大前提である. \\[1zh]
第1属:\bm{\ce{HCl}\,(\ce{Cl-})}で塩化物が沈殿するのは,\ \bm{銀(\ce{Ag+})のなま(\ce{Pb^2+})はげ(\ce{Hg2^2+})}であった. \\[.4zh]
\ \ \, \ce{PbCl2}\,がわずかに水に溶けるためにこの沈殿は不完全で,\ ろ液中に\ce{Pb^2+}\,が残ることがある. \\[1zh]
第2属:最初の塩酸による\bm{酸性条件下で\ce{H2S}\,(\ce{S^2-})を加える}ことになる. \\[.4zh]
\ \ \, この条件では,\ \bm{イオン化列\ce{Sn^2+}から\ce{Ag+}までと\ce{Cd^2+}の硫化物が沈殿する}のであった. \\[.4zh]
\ \ \, ただし,\ \ce{Ag+}はすでに分離済みなので,\ 結局\bm{\ce{CdS},\ \ce{SnS},\ \ce{PbS},\ \ce{CuS},\ \ce{HgS}が沈殿}する. \\[1zh]
第3属:第4属の金属イオンがここで沈殿してしまわないように,\ 一旦\bm{煮沸して\ce{H2S}を追い出す.} \\[.4zh]
\ \ \, また,\ \ce{H2S}を加えたことで,\ \ce{Fe^3+}が還元され,\ \ce{Fe^2+}になっている. \\[.4zh]
\ \ \, そこで,\ \bm{酸化力をもつ酸である硝酸\ce{HNO3}を加え,\ \ce{Fe^2+}を酸化して\ce{Fe^3+}に戻す.} \\[.4zh]
\ \ \, \ce{Fe(OH)2}よりも水酸化鉄(\text{I\hspace{-.1em}I\hspace{-.1em}I})の方が溶解度積が小さく,\ 確実に沈殿させられるからである. \\[.4zh]
\ \ \, (酸化剤)\ \ \ce{HNO3 + 3H+ + 3e- -> NO + 2H2O} (還元剤)\ \ \ce{Fe^2+ -> Fe^3+ + e-} \\[.4zh]
\ \ \, 2式から\ce{e-}を消去して \ce{3Fe^2+ + HNO3 + 3H+ -> 3Fe^3+ + 2H2O + NO} \\[1zh]
\ \ \, さらに,\ 弱塩基\ce{NH3}\,とその塩\ce{NH4Cl}を加える. \\[.2zh]
\ \ \, 弱塩基とその塩の混合液は\bm{緩衝液}(少量の酸や塩基を加えても\ce{pH}がほぼ一定)となる. \\[.4zh]
\ \ \, \ce{NH4+}により,\ \ce{NH3 + H2O <=> NH4+ + OH-}の平衡が左に移動する(ルシャトリエの原理). \\[.4zh]
\ \ \, \ce{OH-}の濃度が小さく保たれ,\ \text{pH}\,8程度になる. \\[.2zh]
\ \ \, \bm{\ce{OH-}を加えると,\ イオン化列\ce{Mg^2+}から\ce{Ag+}までの水酸化物が沈殿する}のであった. \\[.2zh]
\ \ \, ただし,\ 一口に沈殿するとはいっても,\ 各水酸化物の溶解度積には非常に大きな差がある. \\[.2zh]
\ \ \, \text{pH}\,8程度ならば,\ \bm{溶解度積が小さい\ce{Al^3+},\ \ce{Fe^3+},\ \ce{Cr^3+}の水酸化物のみが沈殿する.} \\[.2zh]
\ \ \, 一方,\ 溶解度積が大きい\ce{Mn(OH)2}\,や\ce{Mg(OH)2}\,は沈殿しない. \\[.4zh]
\ \ \, \ce{Mn^2+}や\ce{Mg^2+}が含まれていない場合,\ \ce{NH4Cl}を加える必要はない. \\[.4zh]
\ \ \, また,\ \ce{Zn^2+},\ \ce{Ni^2+},\ \ce{Co^2+}\,は,\ 過剰の\ce{NH3}\,水にはアンミン錯イオンを形成して溶解する. \\[.4zh]
\ \ \, \ce{[Zn(NH3)4]^2+},\ \ce{[Ni(NH3)6]^2+},\ \ce{[Co(NH3)6]^2+} \\[.4zh]
\ \ \, 過剰の\ce{NH3}水で溶けるのは「\bm{銀(\ce{Ag})子(\ce{Co})に(\ce{Ni})どう(\ce{Cu})も会えん(\ce{Zn})}」であった. \\[1zh]
第4属:\ce{NH3}\,による\bm{塩基性条件下で\ce{H2S}\,(\ce{S^2-})を加える}ことになる. \\[.4zh]
\ \ \, \bm{\ce{Zn^2+},\ \ce{Fe^2+},\ \ce{Ni^2+},\ \ce{Mn^2+},\ \ce{Co^2+}が沈殿する}のであった(\ce{Fe^2+}は分離済み). \\[1zh]
第5属:まだ沈殿していない\bm{アルカリ土類金属イオン}を,\ \bm{炭酸イオン\ce{CO3^2-}で沈殿}させる. \\[.4zh]
\ \ \, このとき,\ \ce{(NH4)2CO3}を加えすぎなければ,\ 溶解度積が大きい\ce{MgCO3}\,は沈殿しない. \\[1zh]
\ \ \, アルカリ土類金属イオン\ce{Ca^2+},\ \ce{Ba^2+},\ \ce{Sr^2+}は,\ \ce{SO4^2-}でも沈殿するのであった. \\[.4zh]
\ \ \, しかし,\ 強酸の塩である硫酸塩は再溶解が難しく,\ 後の分離や確認が難しくなる. \\[.2zh]
\ \ \, 弱酸の塩である炭酸塩ならば,\ 塩酸などの酸には\ce{CO2}を発生して溶ける(弱酸の遊離). \\[.4zh]
\ \ \, \rei\ \ \ce{CaCO3 + HCl -> CaCl2 + H2O + CO2 ^} \\[1zh]
第6属:\bm{アルカリ金属イオンと\ce{Mg^2+}が沈殿せずに残る.}\ アルカリ金属イオンは\bm{炎色反応}で確認. \\[.2zh]
炎色反応の操作 \bm{白金線につけた試料水溶液をガスバーナーの外炎に入れる.}
以上の手順では分離しきれない各属の金属イオンは,\ 沈殿物を再溶解して分離する. \\[.2zh]
重要な分離のみ示す. \\
第1属沈殿 \ce{AgCl}\,(白),\ \ce{PbCl2}\,(白),\ \ce{Hg2Cl2}\,(白)}
\ce{AgCl},\ \ce{PbCl2},\ \ce{Hg2Cl2}\,のうち,\ \bm{\ce{PbCl2}\,のみが熱水に溶ける}のであった. \\[.4zh]
\bm{\ce{CrO4^2-}で沈殿するのは,\ \ce{Ag+},\ \ce{Ba^2+},\ \ce{Pb^2+}}\,であった.\ 赤い銀貨(\ce{Ag})と黄色いバ(\ce{Ba})ナナ(\ce{Pb}). \\[.4zh]
\ce{AgCl}は,\ 過剰な\ce{NH3}\,水にはアンミン錯イオンを形成して再溶解する. \\[.4zh]
\ce{Hg2Cl2}\,は特殊な反応によって\ce{Hg}となるが,\ 重要ではない.
第2属沈殿 \ce{CuS}\,(黒),\ \ce{PbS}\,(黒),\ \ce{HgS}\,(黒)}
硝酸の酸化力で\ce{S^2-}を\ce{S}に酸化すると,\ \ce{CuS}と\ce{PbS}が再溶解する. \\[.2zh]
王水にしか溶解しない\ce{HgS}は沈殿物のまま残る. \\[1zh]
(酸化剤)\ \ \ce{HNO3 + 3H+ + 3e- -> NO + 2H2O} (還元剤)\ \ \ce{S^2- -> S + 2e-} \\[.4zh]
2式から\ce{e-}を消去すると \ce{2HNO3 + 3S^2- + 6H+ -> 2NO + 3S + 4H2O} \\[.4zh]
両辺に\ce{Cu^2+}3個と\ce{NO3-}6個を加えて \ce{3CuS + 8HNO3 -> 3Cu(NO3)2 + 4H2O + 2NO + 3S} \\[1zh]
\ce{SO4^2-}で沈殿するのは,\ 「\bm{ば(\ce{Ba})か(\ce{Ca})にする(\ce{Sr})な(\ce{Pb})硫酸}」であった. 両性水酸化物の\ce{Al(OH)3}\,と\ce{Cr(OH)3}\,は,\ 過剰の\ce{NaOH}水を加えると錯イオンとなって再溶解する. \\[.4zh]
さらに,\ 酸化剤\ce{H2O2}\,を加えると,\ \ce{[Cr(OH)4]-}\,(+\,3)が\ce{CrO4^2-}\,(+\,6)に酸化される. \\[.4zh]
希塩酸を加えて酸性にすると\ce{[Al(OH)4]-}が\ce{Al^3+}となり,\ \ce{NH3}\,水により水酸化物が再沈殿する.\ce{ZnS}と\ce{MnS}は,\ 塩酸を加えると再溶解する. \ce{ZnS + 2HCl -> ZnCl2 + H2S}\ (弱酸の遊離) \\[.4zh]
一方,\ \ce{NiS}と\ce{CoS}は加熱でより溶解度が小さい結晶に変化しており,\ 溶解しない. \\[.2zh]
両性金属の\ce{Zn}は,\ 過剰の\ce{NaOH}水を加えると錯イオンを形成する.
酢酸も弱酸だが,\ 炭酸よりは強い(有機化学)ので弱酸の遊離反応が起こる. \\[.2zh]
\ce{CaCO3 + 2CH3COOH -> (CH3COO)2Ca + CO2 + H2O}\ (弱酸の遊離

