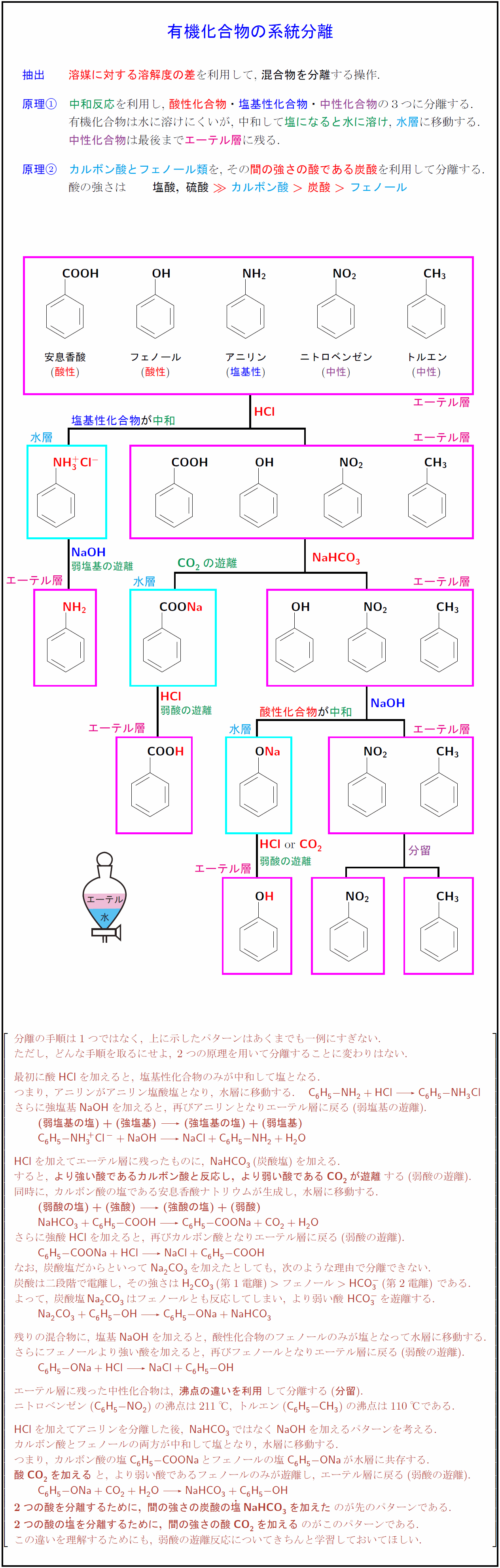
抽出 溶媒に対する溶解度の差を利用して, 混合物を分離}する操作. {原理 中和反応を利用し,\ 酸性化合物}・塩基性化合物}・中性化合物の3つに分離する. 有機化合物は水に溶けにくいが, 中和して\塩になると水に溶け, 水層に移動する. 中性化合物は最後までエーテル層に残る. 原理 カルボン酸とフェノール類を,\ その間の強さの酸である炭酸を利用して分離する. 酸の強さは ${塩酸,\ 硫酸\ カルボン酸}炭酸}\ 安息香酸}フェノール}酸性アニリン塩基性}ニトロベンゼン}エーテル層}水層塩基性化合物}が中和} NaHCO₃CO₂}の遊離酸性化合物}が分留弱塩基の遊離} 弱酸の遊離 分離の手順は1つではなく,\ 上に示したパターンはあくまでも一例にすぎない. ただし,\ どんな手順を取るにせよ,\ 2つの原理を用いて分離することに変わりはない. 最初に酸{HCl}を加えると,\ 塩基性化合物のみが中和して塩となる. つまり,\ アニリンがアニリン塩酸塩となり,\ 水層に移動する. {C₆H₅-NH₂ + HCl C₆H₅-NH₃Cl} さらに強塩基{NaOH}を加えると,\ 再びアニリンとなりエーテル層に戻る(弱塩基の遊離). {(弱塩基の塩)+(強塩基)}(強塩基の塩)+(弱塩基)} {C₆H₅-NH₃^+Cl^- + NaOH NaCl + C₆H₅-NH₂ + H₂O} {HCl}を加えてエーテル層に残ったものに,\ {NaHCO₃}(炭酸塩)を加える. すると,\ {より強い酸であるカルボン酸と反応し,\ より弱い酸であるCO₂が遊離}する(弱酸の遊離). 同時に,\ カルボン酸の塩である安息香酸ナトリウムが生成し,\ 水層に移動する. {(弱酸の塩)+(強酸)(強酸の塩)+(弱酸)} {NaHCO₃ + C₆H₅-COOH -C₆H₅-COONa + CO₂ + H₂O} さらに強酸{HCl}を加えると,\ 再びカルボン酸となりエーテル層に戻る(弱酸の遊離). {C₆H₅-COONa + HCl NaCl + C₆H₅-COOH} なお,\ 炭酸塩だからといって {Na2CO₃}を加えたとしても,\ 次のような理由で分離できない. 炭酸は二段階で電離し,\ その強さは {H₂CO₃}(第1電離)フェノール{HCO₃-}(第2電離)\ である. よって,\ 炭酸塩{Na2CO₃}はフェノールとも反応してしまい,\ より弱い酸\ {HCO₃-}を遊離する. {Na2CO₃ + C₆H₅-OH C₆H₅-ONa + NaHCO₃} 残りの混合物に,\ 塩基{NaOH}を加えると,\ 酸性化合物のフェノールのみが塩となって水層に移動する. さらにフェノールより強い酸を加えると,\ 再びフェノールとなりエーテル層に戻る(弱酸の遊離). {C₆H₅-ONa + HCl NaCl + C₆H₅-OH} エーテル層に残った中性化合物は,\ {沸点の違いを利用}して分離する({分留}). ニトロベンゼン({C₆H₅-NO₂})の沸点は211℃,\ トルエン({C₆H₅-CH₃})の沸点は110℃である. {HCl}を加えてアニリンを分離した後,\ {NaHCO₃}ではなく{NaOH}を加えるパターンを考える. カルボン酸とフェノールの両方が中和して塩となり,\ 水層に移動する. つまり,\ カルボン酸の塩{C₆H₅-COONa}とフェノールの塩{C₆H₅-ONa}が水層に共存する. {酸CO₂を加える}と,\ より弱い酸であるフェノールのみが遊離し,\ エーテル層に戻る(弱酸の遊離). {C₆H₅-ONa + CO₂ + H₂O NaHCO₃ + C₆H₅-OH} {2つの酸を分離するために,\ 間の強さの炭酸の塩}{NaHCO₃}を加えた}のが先のパターンである. {2つの酸の塩}を分離するために,\ 間の強さの酸CO₂を加える}のがこのパターンである. この違いを理解するためにも,\ 弱酸の遊離反応についてきちんと学習しておいてほしい.

