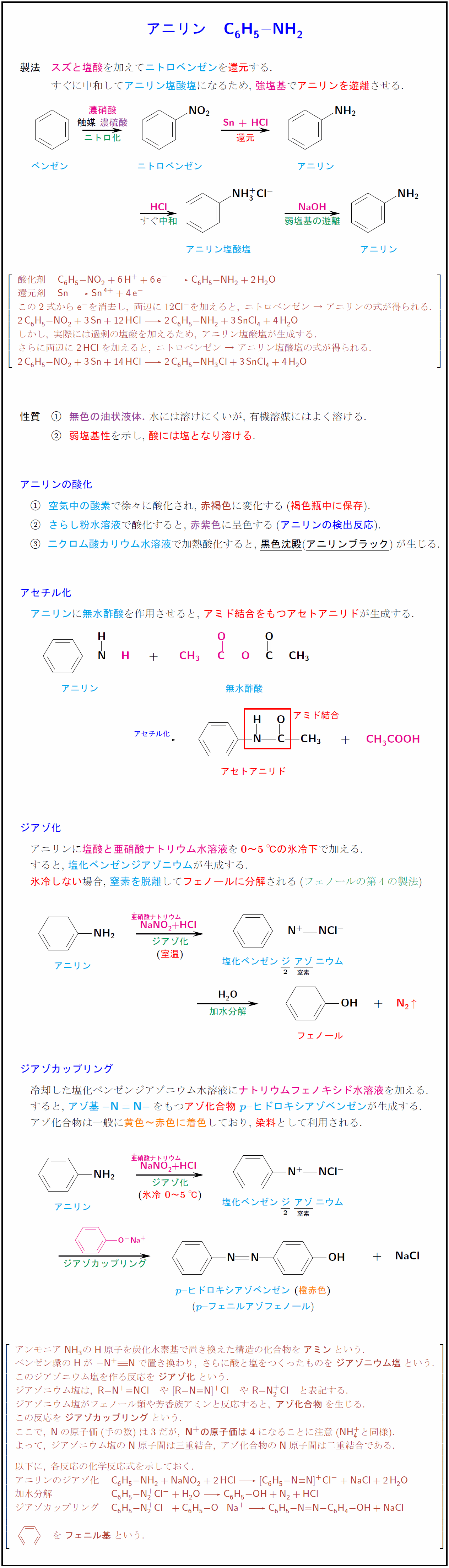
製法} スズと塩酸を加えてニトロベンゼンを還元する. すぐに中和してアニリン塩酸塩になるため, 強塩基でアニリンを遊離させる.ニトロベンゼン触媒 濃硝酸}還元 \アニリン塩酸塩中和} 弱塩基の遊離} 酸化剤 {C₆H₅-NO₂ + 6H+ + 6e- C₆H₅-NH₂ + 2H₂O} 還元剤 {Sn Sn⁴+ + 4e-} この2式から{e-}を消去し,\ 両辺に12{Cl-}を加えると,\ ニトロベンゼン\ →\ アニリンの式が得られる. {2C₆H₅-NO₂ + 3Sn + 12HCl 2C₆H₅-NH₂ + 3SnCl4 + 4H₂O} しかし,\ 実際には過剰の塩酸を加えるため,\ アニリン塩酸塩が生成する. さらに両辺に{2HCl}を加えると,\ ニトロベンゼン\ →\ アニリン塩酸塩の式が得られる. {2C₆H₅-NO₂ + 3Sn + 14HCl 2C₆H₅-NH₃Cl + 3SnCl4 + 4H₂O} 性質} 無色の油状液体.\ 水には溶けにくいが,\ 有機溶媒にはよく溶ける. 弱塩基性を示し, 酸には塩となり溶ける. アニリンの酸化 空気中の酸素で徐々に酸化され,\ {赤褐色に変化する(褐色瓶中に保存). さらし粉水溶液で酸化すると,\ 赤紫色に呈色する(アニリンの検出反応). 二クロム酸カリウム水溶液で加熱酸化すると,\黒色沈殿}(アニリンブラック})が生じる. アセチル化 アニリンに無水酢酸を作用させると, アミド結合をもつアセトアニリドが生成する無水酢酸} アセチル化}]アセトアニリドアミド結合 ジアゾ化 アニリンに\酸と亜硝酸ナトリウム水溶液を\0~5℃の氷冷下で加える. すると, \塩化ベンゼンジアゾニウムが生成する. 氷冷しない場合, 窒素を脱離してフェノールに分解されるフェノールの第4の製法 アニリンジアゾ化亜硝酸ナトリウムNaNO₂室温})} 加水分解 ジアゾカップリング 冷却した塩化ベンゼンジアゾニウム水溶液に\ナトリウムフェノキシド水溶液を加える. するとアゾ基{- N = N -}をもつアゾ化合物\-ヒドロキシアゾベンゼンが生成する. アゾ化合物は一般に{黄色~赤色に着色しており, {染料として利用される. アニリン] 亜硝酸ナトリウムNaNO₂}{HCl}氷冷 0~5℃ ヒドロキシアゾベンゼン} 橙赤色}) -フェニルアゾフェノールジアゾカップリング アンモニアNH₃の{H}原子を炭化水素基で置き換えた構造の化合物を{アミン}という. ベンゼン環の{H}が\ {- N+ # N}で置き換わり,\ さらに酸と塩をつくったものを{ジアゾニウム塩}という. このジアゾニウム塩を作る反応を{ジアゾ化}という. ジアゾニウム塩は,\ {R-N+#NCl-}\ や\ {[R-N#N]+Cl-}\ や\ {R-N₂+Cl-}\ と表記する. ジアゾニウム塩がフェノール類や芳香族アミンと反応すると,\ {アゾ化合物}を生じる. この反応を{ジアゾカップリング}という. ここで,\ {N}の原子価(手の数)は3だが,\ N+}の原子価は4}になることに注意({NH₄+}と同様). よって,\ ジアゾニウム塩の{N}原子間は三重結合,\ アゾ化合物の{N}原子間は二重結合である. 以下に,\ 各反応の化学反応式を示しておく. アニリンのジアゾ化 {C₆H₅-NH₂ + NaNO₂ + 2HCl [C₆H₅-N#N]+Cl- + NaCl + 2H₂O} 加水分解 {C₆H₅-N₂+Cl- + H₂O C₆H₅-OH + N₂ + HCl} ジアゾカップリング {C₆H₅-N₂+Cl- + C₆H₅-O^-Na+ C₆H₅-N=N-C6H4-OH + NaCl}を{フェニル基}という. ₀

