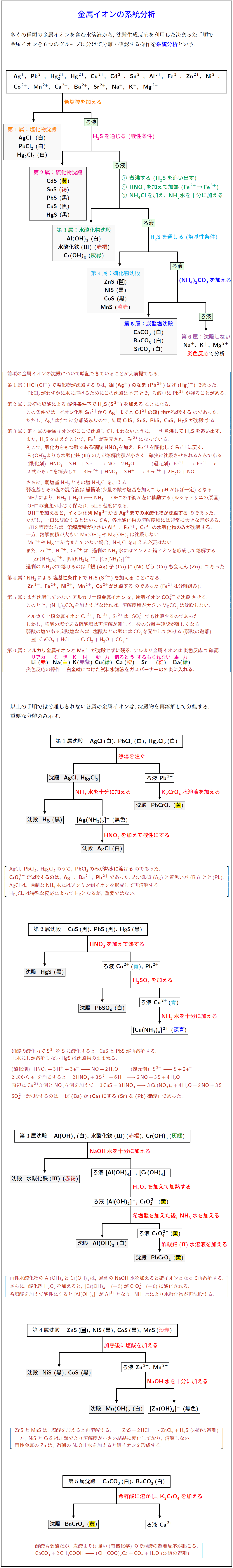
多くの種類の金属イオンを含む水溶液から, 沈殿生成反応を利用した決まった手順で金属イオンを6つのグループに分けて分離・確認する操作を系統分析という.
第1属:HCl (Cl⁻) で塩化物が沈殿するのは, 銀 (Ag⁺) のなま (Pb²⁺) はげ (Hg₂²⁺) であった.
PbCl₂ がわずかに水に溶けるためにこの沈殿は不完全で, ろ液中に Pb²⁺ が残ることがある.
第2属:最初の塩酸による酸性条件下で H₂S (S²⁻) を加えることになる.
この条件では, イオン化列 Sn²⁺ から Ag⁺ までと Cd²⁺ の硫化物が沈殿するのであった.
ただし, Ag⁺ はすでに分離済みなので, 結局 CdS, SnS, PbS, CuS, HgS が沈殿する.
第3属:第4属の金属イオンがここで沈殿してしまわないように, 一旦煮沸して H₂S を追い出す.
また, H₂S を加えたことで Fe³⁺ が還元され, Fe²⁺ になっている.
そこで, 酸化力をもつ酸である硝酸 HNO₃ を加え, Fe²⁺ を酸化して Fe³⁺ に戻す.
Fe(OH)₂ よりも水酸化鉄 (III) の方が溶解度積が小さく, 確実に沈殿させられるからである.
(酸化剤) HNO₃ + 3H⁺ + 3e⁻ → NO + 2H₂O
(還元剤) Fe²⁺ → Fe³⁺ + e⁻
2式から e⁻ を消去して
3Fe²⁺ + HNO₃ + 3H⁺ → 3Fe³⁺ + 2H₂O + NO
さらに, 弱塩基 NH₃ とその塩 NH₄Cl を加える.
弱塩基とその塩の混合液は緩衝液 (少量の酸や塩基を加えても pH がほぼ一定) となる.
NH₄⁺ により, NH₃ + H₂O ⇌ NH₄⁺ + OH⁻ の平衡が左に移動する (ルシャトリエの原理).
OH⁻ の濃度が小さく保たれ, pH 8 程度になる.
OH⁻ を加えると, イオン化列 Mg²⁺ から Ag⁺ までの水酸化物が沈殿するのであった.
ただし, 各水酸化物の溶解度積には非常に大きな差がある.
pH 8 程度ならば, 溶解度積が小さい Al³⁺, Fe³⁺, Cr³⁺ の水酸化物のみが沈殿する.
一方, Mn(OH)₂ や Mg(OH)₂ は沈殿しない.
Mn²⁺ や Mg²⁺ が含まれていない場合, NH₄Cl を加える必要はない.
また, Zn²⁺, Ni²⁺, Co²⁺ は過剰の NH₃ 水によりアンミン錯イオンを形成して溶解する.
[Zn(NH₃)₄]²⁺, [Ni(NH₃)₆]²⁺, [Co(NH₃)₆]²⁺
過剰の NH₃ 水で溶けるのは「銀 (Ag) 子 (Co) に (Ni) どう (Cu) も 会えん (Zn)」であった.
第4属:NH₃ による塩基性条件下で H₂S (S²⁻) を加えることになる.
Zn²⁺, Fe²⁺, Ni²⁺, Mn²⁺, Co²⁺ が沈殿するのであった(Fe²⁺ は分離済み).
第5属:まだ沈殿していないアルカリ土類金属イオンを, 炭酸イオン CO₃²⁻ で沈殿させる.
このとき, (NH₄)₂CO₃ を加えすぎなければ, 溶解度積が大きい MgCO₃ は沈殿しない.
アルカリ土類金属イオン Ca²⁺, Ba²⁺, Sr²⁺ は, SO₄²⁻ でも沈殿するのであった.
しかし, 強酸の塩である硫酸塩は再溶解が難しく, 後の分離や確認が難しくなる.
弱酸の塩である炭酸塩ならば, 塩酸などの酸には CO₂ を発生して溶ける(弱酸の遊離).
CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂↑
第6属:アルカリ金属イオンと Mg²⁺ が沈殿せずに残る.
アルカリ金属イオンは炎色反応で確認する.
Li(赤), Na(黄), K(赤紫), Cu(緑), Ca(橙), Sr(紅), Ba(緑)
炎色反応の操作:白金線につけた試料水溶液をガスバーナーの外炎に入れる.
第1属の再分離:
AgCl, PbCl₂, Hg₂Cl₂ のうち, PbCl₂ のみが熱水に溶ける.
よって熱水で処理すると, 溶液中には Pb²⁺ が残る.
Pb²⁺ を含む溶液に K₂CrO₄ 水溶液を加えると, PbCrO₄(黄)が沈殿する.
CrO₄²⁻ で沈殿するのは, Ag⁺, Ba²⁺, Pb²⁺ であった(赤い銀貨と黄色いバナナ).
AgCl は, 過剰な NH₃ 水で [Ag(NH₃)₂]⁺(無色) となり再溶解する.
Hg₂Cl₂ は特殊な反応により Hg(黒)となるが, 高校範囲では重要でない.
第2属の再分離:
CuS, PbS, HgS の沈殿に HNO₃ を加えて加熱すると,
硝酸の酸化力で S²⁻ が S に酸化され, CuS と PbS は溶解する.
王水にしか溶けない HgS は沈殿のまま残る.
(酸化剤) HNO₃ + 3H⁺ + 3e⁻ → NO + 2H₂O
(還元剤) S²⁻ → S + 2e⁻
これらを合わせると:
2HNO₃ + 3S²⁻ + 6H⁺ → 2NO + 3S + 4H₂O
さらに Cu²⁺, NO₃⁻ を含めて
3CuS + 8HNO₃ → 3Cu(NO₃)₂ + 4H₂O + 2NO + 3S
SO₄²⁻ で沈殿するのは「Ba, Ca, Sr, Pb」すなわち「ばかにするな硫酸」であった.
第3属の再分離:
Al(OH)₃ と Cr(OH)₃ は両性水酸化物であり, 過剰の NaOH 水を加えると錯イオンとなって再溶解する.
Al(OH)₃ + OH⁻ → [Al(OH)₄]⁻
Cr(OH)₃ + OH⁻ → [Cr(OH)₄]⁻
さらに, 酸化剤 H₂O₂ を加えて加熱すると,
[Cr(OH)₄]⁻ (+3) → CrO₄²⁻ (+6) に酸化される.
希塩酸を加えて酸性にすると, [Al(OH)₄]⁻ が Al³⁺ となり, NH₃ 水を加えることで再び Al(OH)₃ が沈殿する.
第4属の再分離:
ZnS と MnS は酸に可溶であり, HCl を加えると再溶解する.
ZnS + 2HCl → ZnCl₂ + H₂S↑
一方, NiS と CoS は加熱により溶解度の小さい結晶へと変化しており, HCl では溶けない.
Zn は両性金属であるため, 過剰の NaOH 水を加えると [Zn(OH)₄]²⁻ を形成して溶ける.
第5属の再分離:
CaCO₃ と BaCO₃ の混合沈殿に希酢酸を加えると, 炭酸が弱酸であるため弱酸の遊離反応が起こる.
CaCO₃ + 2CH₃COOH → (CH₃COO)₂Ca + CO₂ + H₂O
Ba²⁺ に K₂CrO₄ を加えると, BaCrO₄(黄)が沈殿する.
Ca²⁺ はろ液中に残る.

