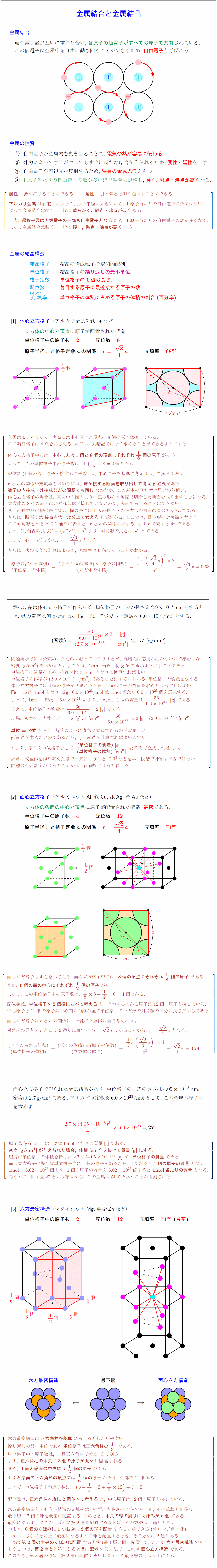
最外電子殻が互いに重なり合い,\ 各原子の価電子がすべての原子で共有されている. この価電子は金属中を自由に動き回ることができるため,\ 自由電子と呼ばれる. 金属の性質 自由電子が金属内を動き回ることで,\ 電気や熱が容易に伝わる. 外力によってずれが生じてもすぐに新たな結合が作られるため,\ 展性・延性を示す. 自由電子が可視光を反射するため,\ 特有の金属光沢をもつ. 1原子当たりの自由電子の数が多いほど結合力が増し},\ 硬く,\ 融点・沸点が高くなる. {展性} 薄く広げることができる. {延性} 引っ張ると細く延ばすことができる. {アルカリ金属}は価電子が少なく,\ 原子半径が大きいため,\ 1原子当たりの自由電子の数が少ない. よって金属結合は弱く,\ 一般に{軟らかく,\ 融点・沸点が低く}なる. 一方,\ {遷移金属は内殻電子の一部も自由電子となる}ため,\ 1原子当たりの自由電子の数が多くなる. よって金属結合は強く,\ 一般に{硬く,\ 融点・沸点が高く}なる. 金属の結晶構造 結晶格子 結晶の構成粒子の空間的配列. 単位格子 結晶格子の繰り返しの最小単位. 格子定数 単位格子の1辺の長さ. 配位数 着目する原子に最近接する原子の数. {充}{.7}{ じゅう}{填}{.7}{ てん}率 \ 単位格子の体積に占める原子の体積の割合(百分率).体心立方格子(アルカリ金属や鉄{Fe}など) 立方{体}の中{心}と頂点に原子が配置された構造. 単位格子中の原子数 2} 配位数 8 原子半径${r}$と格子定数${a}$の関係 左図はモデルであり,\ 実際には中心原子と頂点の8個の原子は接している. この結晶格子は4点をおさえる.\ ただし,\ 丸暗記ではなく求めることができるようにする. 体心立方格子中には,\ {中心に丸々1個と8個の頂点にそれぞれ18個の原子}がある. よって,\ この単位格子中の原子数は,\ 1+188=2個である. 配位数(1個の着目原子と接する原子数)は,\ 中心原子を基準に考えれば,\ 当然8である. rとaの関係や充填率を求めるには,\ {球が接する断面を取り出して考える}必要がある. {数学の内接球・外接球などの問題でも同じ}なのだが,\ この基本の認知度は思いの外低い. 体心立方格子の場合は,\ 真ん中の図のように正方形の対角線で切断した断面を取り出すことになる. 立方体の8つの表面はいずれも球が接していないので,\ 表面で考えることはできない. 断面の長方形の縦の長さはa,\ 横の長さは1辺の長さaの正方形の対角線なので2aである. さらに,\ 断面では{接点を含む線分上で考える}必要がある.\ ここでは,\ 長方形の対角線を考える. この対角線をrとaで2通りに表すと,\ rとaの関係が求まる.\ まずrで表すと4rである. また,\ (対角線の長さ)²=(2a)²+a²\ より,\ 対角線の長さは\ 3a\ である. よって,\ 4r=3a\ から,\ r={3}{4}a\ となる. さらに,\ 次のような計算によって,\ 充填率は68\%であることがわかる. {(原子の占める体積)}{(単位格子の体積)}={(原子の体積)(原子の個数)}{(立方体の体積)}=鉄の結晶は体心立方格子で作られる.\ 単位格子の一辺の長さを$2.910^{-8}$\ cmとすると き,\ 鉄の密度は何g/cm$³$か.${Fe}=56$,\ アボガドロ定数を$6.010^{23}$/molとする. 問題集などには公式めいたものが載っていたりするが,\ 丸暗記は応用が利かないので感心しない. 密度(g/cm³)を求めよということは,\ {1cm}³当たり何gか}を求めよということである. 単位格子の質量を求め,\ それを比で1cm³当たりに換算すればよい. 単位格子の体積が\ (2.910^{-8})³\ [cm³]\ なのはすぐわかる.\ 単位格子の質量を求める. 体心立方格子には2個の原子が含まれるから,\ 1個の原子の質量を求めて2倍すればよい. {Fe}=56は\ 1mol}当たり56g},\ 6.010^{23}/mol}は\ 1mol}当たり6.010^{23}個を意味する. よって,\ 1mol}=56g}=6.010^{23}個\ より,\ {Fe}原子1個の質量は\ {56}{6.010^{23\ [g}]\ である. ゆえに,\ 単位格子の質量は\ {56}{6.010^{232\ [g}]\ である. 結局,\ 密度をxとすると x\ [g}]:1\ [cm³]={56}{6.010^{232\ [g]}:(2.910^{-8})³\ [cm³] {単位=公式}と考え,\ 解答のように直ちに立式できるのが望ましい. g/cm³を求めたいのであるから,\ g}cm³を計算すればよいのである. つまり,\ 基準を単位格子として\ (単位格子の質量)\ [g]}\ }{(単位格子の体積)\ [cm³]\ と考えて立式すればよい. 計算は式全体を作り終えた後で一気に行うこと.\ 2.9³などを早い段階で計算すべきではない. 問題の有効数字が2桁であるから,\ 有効数字2桁で答える. 面心立方格子(アルミニウム{Al},\ 銅{Cu},\ 銀{Ag},\ 金{Au}など) 立方体の各{面}の中{心}と頂点に原子が配置された構造.\ 最密である. 単位格子中の原子数 4} 配位数 12 原子半径${r}$と格子定数${a}$の関係 充填率 面心立方格子も4点をおさえる.\ 面心立方格子中には,\ {8個の頂点にそれぞれ18個の原子}がある. また,\ {6個の面の中心にそれぞれ12個の原子}がある. よって,\ この単位格子中の原子数は,\ 188+126=4個である. 配位数は,\ {単位格子を2個横に並べて考える}と,\ その中心にある原子は12個の原子と接している. 中心原子と12個の原子の中心間の距離が全て単位格子の正方形の対角線の半分の長さだからである. 面心立方格子のrとaの関係は,\ 単純に立方体の面で考えればよい. 対角線の長さをrとaで2通りに表すと\ 4r=2a\ であることから,\ r={2}{4}a\ となる. {(原子の占める体積)}{(単位格子の体積)}={(原子の体積)(原子の個数)}{(立方体の体積)}={43π\l面心立方格子で作られた金属結晶があり,\ 単位格子の一辺の長さは$4.0510^{-8}$\ cm, 密度は$2.7$g/cm$³$である.\ アボガドロ定数を$6.010^{23}$/molとして,\ この金属の原子量 原子量[g/mol]}とは,\ 要は1mol}当たりの質量[g]}である. {密度[g/cm³]が与えられた場合,\ 体積[cm³]を掛けて質量[g}]にする.} 密度に単位格子の体積を掛けた2.7(4.0510^{-8})³\ [g}]\ が,\ {単位格子の質量}である. 面心立方格子の場合は単位格子内に4個の原子があるから,\ 4で割って{1個の原子の質量}とする. 1mol}=6.0210^{23}個より,\ 1個の原子の質量を\ 6.0210^{23}倍すると\ {1mol当たりの質量}となる. ちなみに,\ 原子量27という結果から,\ この金属は{Al}であろうことが推測される. 六方最密構造(マグネシウム{Mg},\ 亜鉛{Zn}など) 単位格子中の原子数 2} 配位数 12} 充填率 ${74\%$\ (最密})} [-3zh] 六方最密構造は{正六角柱を基準}に考えるとわかりやすい. 繰り返しの最小単位である{単位格子は正六角柱の1/3}である. 単位格子中の原子数は,\ 一旦正六角柱で考え,\ 3で割る. まず,\ {中央に3個の原子が丸々1個}含まれる.\ また,\ {上面と底面の中央には1/2個の原子}がある. {上面と底面の正六角形の頂点には1/6個の原子}があり,\ 全部で12個ある. よって,\ 単位格子中の原子数は 配位数は,\ {正六角柱を縦に2個並べて考える}と,\ 中心原子は12個の原子と接している. 六方最密構造と面心立方構造の充填率は,\ いずれも最密の74\%であるが,\ その重ね方が異なる. 最下層に7個の球を最密に配置する.\ このとき,\ {中央の球の周りにくぼみが6個}できる. 最密になるようにこのくぼみに第2層を配置するならば,\ その方法は1通りである. つまり,\ {6個のくぼみに1つおきに3個の球を配置}することができる(オレンジ色の球). しかし,\ さらにその上に最密になるように球を配置するとき,\ その方法は2通りある. 1つは{第2層の中央のくぼみに配置}する方法(最下層と同じ配置)で,\ これが{六方最密構造}である. もう1つは,\ {第2層と対称になるように配置}する方法で,\ これが{面心立方構造}である. このとき,\ 第3層の球は,\ 第2層の配置で使用しなかった最下層のくぼみ上にある.

