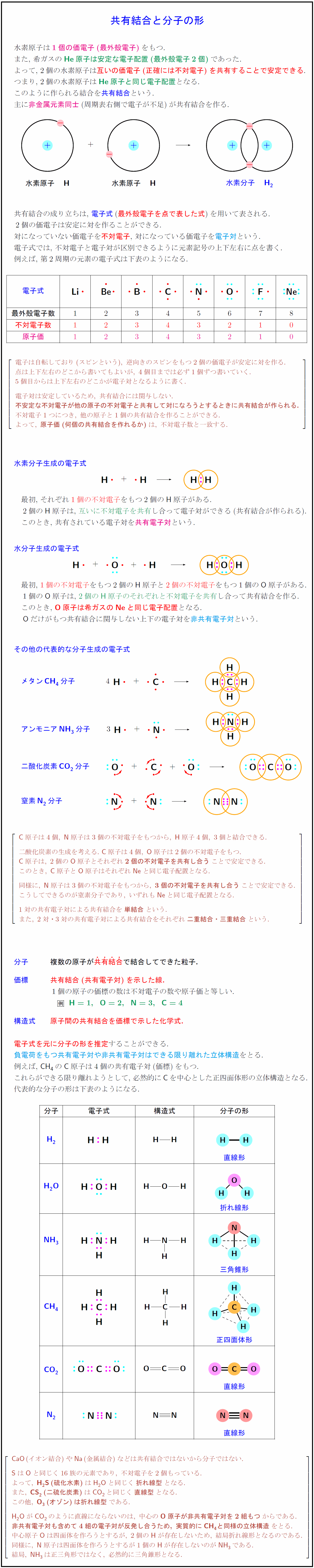
水素原子は1個の価電子(最外殻電子)をもつ. また,\ 希ガスの{He}原子は安定な電子配置(最外殻電子2個)であった. よって,\ 2個の水素原子は互いの価電子(正確には不対電子)を共有することで安定できる. つまり,\ 2個の水素原子は{He}原子と同じ電子配置となる. このように作られる結合を共有結合という. 主に非金属元素同士(周期表右側で電子が不足)が共有結合を作る. 共有結合の成り立ちは,\ 電子式(最外殻電子を点で表した式)を用いて表される. 2個の価電子は安定に対を作ることができる. 対になっていない価電子を不対電子,\ 対になっている価電子を電子対という. 電子式では,\ 不対電子と電子対が区別できるように元素記号の上下左右に点を書く. 例えば,\ 第2周期の元素の電子式は下表のようになる. 最外殻電子数}不対電子数原子価} 電子は自転しており(スピンという),\ 逆向きのスピンをもつ2個の価電子が安定に対を作る. 点は上下左右のどこから書いてもよいが,\ 4個目までは必ず1個ずつ書いていく. 5個目からは上下左右のどこかが電子対となるように書く. 電子対は安定しているため,\ 共有結合には関与しない. {不安定な不対電子が他の原子の不対電子と共有して対になろうとするときに共有結合が作られる.} 不対電子1つにつき,\ 他の原子と1個の共有結合を作ることができる. よって,\ {原子価(何個の共有結合を作れるか)}は,\ 不対電子数と一致する. 水素分子生成の電子式} 最初,\ それぞれ1個の不対電子}をもつ2個の{H}原子がある. 2個の{H}原子は,\ 互いに不対電子を共有}し合って電子対ができる(共有結合が作られる). このとき,\ 共有されている電子対を共有電子対という. 水分子生成の電子式 最初,\ 1個の不対電子}をもつ2個の{H}原子と2個の不対電子}をもつ1個の{O}原子がある. 1個の{O}原子は,\ 2個の{H}原子のそれぞれと不対電子を共有}し合って共有結合を作る. このとき,\ {O}原子は希ガスの{Ne}と同じ電子配置となる. {O}だけがもつ共有結合に関与しない上下の電子対を非共有電子対という.メタンCH₄分子アンモニアNH₃分子}二酸化炭素CO₂分子}窒素{N₂}分子 {C}原子は4個,\ {N}原子は3個の不対電子をもつから,\ {H}原子4個,\ 3個と結合できる. 二酸化炭素の生成を考える.\ {C}原子は4個,\ {O}原子は2個の不対電子をもつ. {C}原子は,\ 2個の{O}原子とそれぞれ{2個の不対電子を共有し合う}ことで安定できる. このとき,\ {C}原子と{O}原子はそれぞれ{Ne}と同じ電子配置となる. 同様に,\ {N}原子は3個の不対電子をもつから,\ {3個の不対電子を共有し合う}ことで安定できる. こうしてできるのが窒素分子であり,\ いずれも{Ne}と同じ電子配置となる. 1対の共有電子対による共有結合を{単結合}という. また,\ 2対・3対の共有電子対による共有結合をそれぞれ{二重結合・三重結合}という. {分子 複数の原子が{共}{有}{結}{合で結合してできた粒子.} 価標 共有結合(共有電子対)を示した線. 1個の原子の価標の数は不対電子の数や原子価と等しい{H}=1,{O}=2,{N}=3,{C}=4$ 構造式 原子間の共有結合を価標で示した化学式. 電子式を元に分子の形を推定することができる. 負電荷をもつ共有電子対や非共有電子対はできる限り離れた立体構造をとる. 例えば,\ CH₄の{C}原子は4個の共有電子対(価標)をもつ. これらができる限り離れようとして,\ 必然的に{C}を中心とした正四面体形の立体構造となる. 代表的な分子の形は下表のようになる. 折れ線形}三角錐形正四面体形直線形 {CaO}(イオン結合)や{Na}(金属結合)などは共有結合ではないから分子ではない. {S}は{O}と同じく16族の元素であり,\ 不対電子を2個もっている. よって,\ H₂S}(硫化水素)}はH₂Oと同じく{折れ線型}となる. また,\ CS2}(二硫化炭素)}はCO₂と同じく{直線型}となる. この他,\ O3}(オゾン)は折れ線型}である. H₂OがCO₂のように直線にならないのは,\ 中心のO}原子が非共有電子対を2組もつ}からである. {非共有電子対も含めて4組の電子対が反発し合うため,\ 実質的にCH₄と同様の立体構造}をとなる. 中心原子{O}は四面体を作ろうとするが,\ 2個の{H}が存在しないため,\ 結局折れ線形となるのである. 同様に,\ {N}原子は四面体を作ろうとするが1個の{H}が存在しないのがNH₃である. 結局,\ NH₃は正三角形ではなく,\ 必然的に三角錐形となる.

