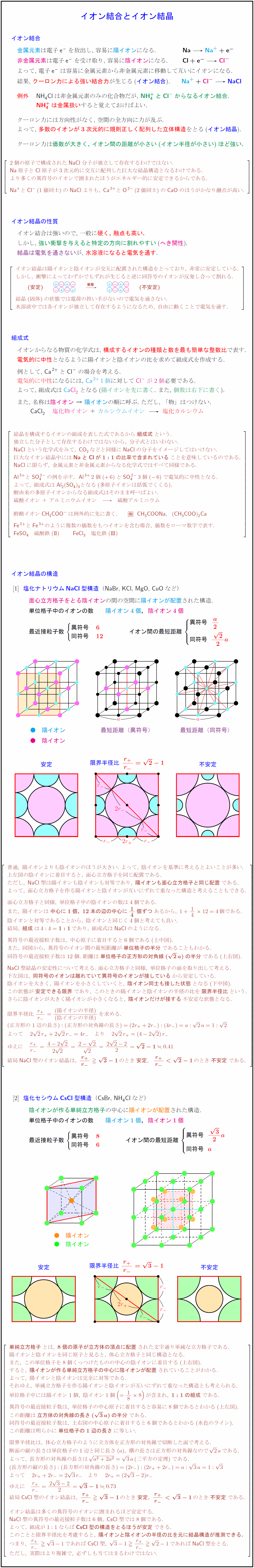
金属元素は電子{e-}を放出し,\ 容易に陽イオンになる. {Na+ + {e-$ 非金属元素は電子{e-}を受け取り,\ 容易に陰イオンになる. {Cl-}$ よって,\ 電子{e-}は容易に金属元素から非金属元素に移動して互いにイオンになる. 結果,\ クーロン力による強い結合力が生じる(イオン結合). $Na+ + {Cl-{NaCl}$ 例外 {NH₄Cl}は非金属元素のみの化合物だが,\ {NH₄+}と{Cl-}からなるイオン結合. {NH₄+}は金属扱いすると覚えておけばよい. クーロン力には方向性がなく,\ 空間の全方向に力が及ぶ. よって,\ 多数のイオンが3次元的に規則正しく配列した立体構造をとる(イオン結晶). クーロン力は価数が大きく,\ イオン間の距離が小さい(イオン半径が小さい)ほど強い. 2個の原子で構成された{NaCl}分子が独立して存在するわけではない. {Na}原子と{Cl}原子が3次元的に交互に配列した巨大な結晶構造となるわけである. より多くの異符号のイオンで囲まれたほうがエネルギー的に安定できるからである. {Na+}と{Cl-}(1価同士)の{NaCl}よりも,\ {Ca²+}と{O²-}(2価同士)の{CaO}のほうがかなり融点が高い. イオン結晶の性質 イオン結合は強いので,\ 一般に硬く,\ 融点も高い. しかし,\ 強い衝撃を与えると特定の方向に割れやすい(へき開性). 結晶は電気を通さないが,\ 水溶液になると電気を通す. イオン結晶は陽イオンと陰イオンが交互に配置された構造をとっており,\ 非常に安定している. しかし,\ 衝撃によってわずかでもずれが生じると逆に同符号のイオンが反発し合って割れる. {(安定)}衝撃}]} {(不安定)} 結晶(固体)の状態では電荷の担い手がないので電気を通さない. 水溶液中では各イオンが独立して存在するようになるため,\ 自由に動くことで電気を通す. 組成式 イオンからなる物質の化学式は,\ 構成するイオンの種類と数を最も簡単な整数比で表す. 電気的に中性となるように陽イオンと陰イオンの比を求めて組成式を作成する. 例として,\ {Ca²+}と{Cl-}の場合を考える. 電気的に中性}になるには,\ {Ca²+}1個}に対して{Cl-}が2個}必要である. よって,\ 組成式は{Ca{Cl₂となる(陽イオンを先に書く}.\ また,\ 個数は右下に書く}). また,\ 名称は陰イオン}\ →\ 陽イオンの順に呼ぶ.\ ただし,\ 「物」はつけない. {CaCl₂} 塩化物イオン}\ +\ カルシウムイオン}塩化カルシウム} \ 結晶を構成するイオンの組成を表した式であるから{組成式}という. 独立した分子として存在するわけではないから,\ 分子式とはいわない. {NaCl}という化学式をみて,\ CO₂などと同様に{NaCl}の分子をイメージしてはいけない. 巨大なイオン結晶中にはNa}と{Cl}が1:1の比率で含まれている}ことを意味しているのである. {NaCl}に限らず,\ 金属元素と非金属元素からなる化学式ではすべて同様である. {Al³+}と{SO₄²-}の例を示す.{Al³+}2個(+6)と{SO₄²-}3個(-6)で電気的に中性となる. よって,\ 組成式は{Al2(SO₄)3}となる(多原子イオンは括弧でくくる). 酸由来の多原子イオンからなる組成式はそのまま呼べばよい. 硫酸イオン\ +\ アルミニウムイオン硫酸アルミニウム 酢酸イオン{CH₃COO-}は例外的に先に書く. {CH₃COONa},{(CH₃COO)2Ca} {Fe²+}と{Fe³}のように複数の価数をもつイオンを含む場合,\ 価数をローマ数字で表す. {FeSO₄} 硫酸鉄(II}) {FeCl3} 塩化鉄( $$塩化ナトリウム{NaCl}型構造({NaBr},\ {KCl},\ {MgO},\ {CuO}など) 面心立方格子をとる陰イオンの間の空間に陽イオンが配置された構造. 単位格子中のイオンの数 陽イオン4個},陰イオン4個 最近接粒子数}\ }$ イオン間の最短距離}\ ${ 異符号同符号普通,\ 陽イオンよりも陰イオンのほうが大きい.\ よって,\ 陰イオンを基準に考えるとよいことが多い. 上左図の陰イオンに着目すると,\ 面心立方格子を同じ配置である. ただし,\ {NaCl}型は陽イオンも陰イオンも対等であり,\ {陽イオンも面心立方格子と同じ配置}である. よって,\ 面心立方格子を作る陽イオンと陰イオンが互いにずれて重なった構造と考えることもできる. 面心立方格子と同様,\ 単位格子中の陰イオンの数は4個である. また,\ 陽イオンは{中心に1個,\ 12本の辺の中心に14個ずつ}あるから,\ 1+1412=4個である. 陰イオンと対等であることから,\ 陰イオンと同じく4個と考えても良い. 結局,\ {組成}は4:4={1:1}であり,\ 組成式は{NaCl}のようになる. 異符号の最近接粒子数は,\ 中心原子に着目すると6個である(上中図). また,\ 同図から,\ 異符号のイオン間の最短距離が{単位格子の半分}であることもわかる. 同符号の最近接粒子数は12個.\ 距離は{単位格子の正方形の対角線(2a)の半分}である(上右図). {NaCl}型結晶の安定性について考える.\ 面心立方格子と同様,\ 単位格子の面を取り出して考える. 下左図は,\ {同符号のイオンは離れていて異符号のイオンが接している}から安定している. 陰イオンを大きく,\ 陽イオンを小さくしていくと,\ {陰イオン同士も接した状態}となる(下中図). この状態が{安定できる限界}であり,\ このときの陽イオンと陰イオンの半径の比を{限界半径比}という. さらに陰イオンが大きく陽イオンが小さくなると,\ {陰イオンだけが接する}不安定な状態となる. 限界半径比\ {r_+}{r_-}={(陽イオンの半径)}{(陰イオンの半径)}を求める. (正方形の1辺の長さ):(正方形の対角線の長さ)=(2r_++2r_-):(4r_-)=1:2 結局{NaCl}型のイオン結晶は,\ r_+}{r_-}2-1}のとき{安定},r_+}{r_-}塩化セシウム{CsCl}型構造({CsBr},\ {NH₄Cl}など) 陰イオンが作る単純立方格子の中心に陽イオンが配置された構造. 単位格子中のイオンの数 陽イオン1個},陰イオン1個 最近接粒子数}\ 異符号 8} 同符号 6} }$ イオン間の最短距離}\ 同符号\ \限界半径比 {単純立方格子}とは,\ {8個の原子が立方体の頂点に配置}された文字通り単純な立方格子である. 陽イオンと陰イオンを同じ原子と見ると,\ 体心立方格子と同じ構造となる. また,\ この単位格子を8個くっつけたものの中心の陰イオンに着目する(上右図). すると,\ {陽イオンが作る単純立方格子の中心に陰イオンが配置}されていることがわかる. よって,\ 陽イオンと陰イオンは完全に対等である. それゆえ,\ 単純立方格子を作る陽イオンと陰イオンが互いにずれて重なった構造とも考えられる. 単位格子中には陽イオン1個,\ 陰イオン1個(=188)が含まれ,\ {1:1の組成}である. 異符号の最近接粒子数は,\ 単位格子の中心原子に着目すると容易に8個であるとわかる(上左図). この距離は{立方体の対角線の長さ(3a)の半分}である. 同符号の最近接粒子数は,\ 上右図の中心原子に着目すると6個であるとわかる(水色のライン). この距離は明らかに{単位格子の1辺の長さ}に等しい. 限界半径比は,\ 体心立方格子のように立方体を正方形の対角線で切断した面で考える. 断面の縦の長さは単位格子の1辺と同じ長さ(a),\ 横の長さは正方形の対角線なので2aである. よって,\ 長方形の対角線の長さは3aである. (長方形の縦の長さ):(長方形の対角線の長さ)=(2r_-):(2r_++2r_-)=1:3 よって 2r_++2r_-=23r_- より 2r_+=(23-2)r_- ゆえに {r_+}{r_-}={23-2}{2}={3-1}0.73 結局{CsCl}型のイオン結晶は,イオン結晶は多くの異符号のイオンに囲まれるほど安定する. {NaCl}型の異符号の最近接粒子数は6個,\ {CsCl}型では8個である. よって,\ 組成が1:1ならばCsCl}型の構造をとるほうが安定}できる. このことと限界半径比を考慮すると,\ {陽イオンと陰イオンの半径の比を元に結晶構造が推測できる.} つまり,\ {r_+}{r_-}3-1であれば{CsCl}型,\であれば{NaCl}型をとる. ただし,\ 実際はより複雑で,\ 必ずしも当てはまるわけではない.

