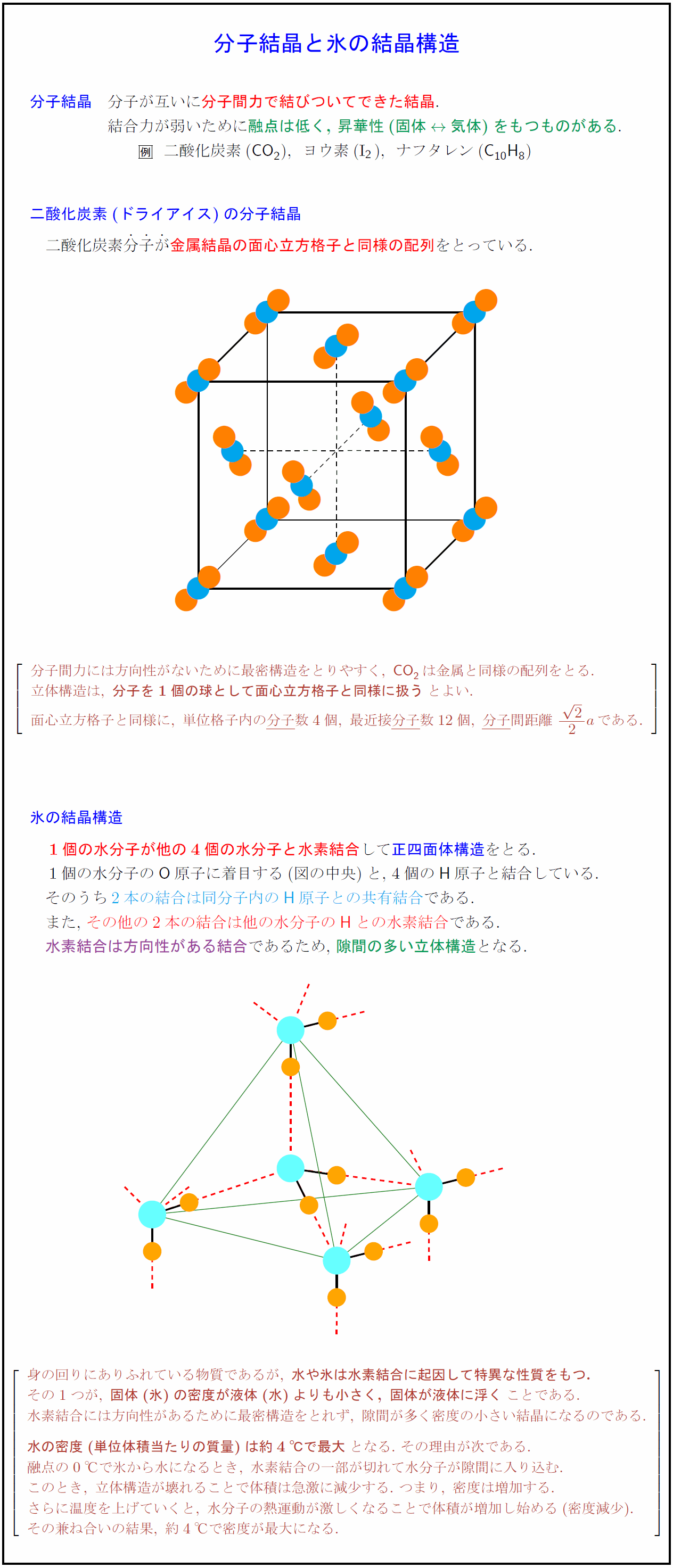
分子結晶 分子が互いに分子間力で結びついてできた結晶. 結合力が弱いために融点は低く,\ 昇華性(固体$rightarrow$気体)をもつものがある. 二酸化炭素(CO₂),ヨウ素(I$_2$),ナフタレン({C10H8}) 二酸化炭素(ドライアイス)の分子結晶 二酸化炭素分子が金属結晶の面心立方格子と同様の配列をとっている. ₀ 分子間力には方向性がないために最密構造をとりやすく,\ CO₂は金属と同様の配列をとる. 立体構造は,\ {分子を1個の球として面心立方格子と同様に扱う}とよい. 面心立方格子と同様に,\ 単位格子内の分子}数4個,\ 最近接分子}数12個,\ 分子}間距離\ {2}{2}aである. 氷の結晶構造 1個の水分子が他の4個の水分子と水素結合して正四面体構造をとる. 1個の水分子の{O}原子に着目する(図の中央)と,\ 4個の{H}原子と結合している. そのうち2本の結合は同分子内の{H}原子との共有結合}である. また,\ その他の2本の結合は他の水分子の{H}との水素結合}である. 水素結合には方向性があるため,\ 隙間の多い立体構造となる. 身の回りにありふれている物質であるが,\ {水や氷は水素結合に起因して特異な性質をもつ.} その1つが,\ {固体(氷)の密度が液体(水)よりも小さく,\ 固体が液体に浮く}ことである. 水素結合には方向性があるために最密構造をとれず,\ 隙間が多く密度の小さい結晶になるのである. {水の密度(単位体積当たりの質量)は約4℃で最大}となる.\ その理由が次である. 融点の0℃で氷から水になるとき,\ 水素結合の一部が切れて水分子が隙間に入り込む. このとき,\ 立体構造が壊れることで体積は急激に減少する.\ つまり,\ 密度は増加する. さらに温度を上げていくと,\ 水分子の熱運動が激しくなることで体積が増加し始める(密度減少). その兼ね合いの結果,\ 約4℃で密度が最大になる.

