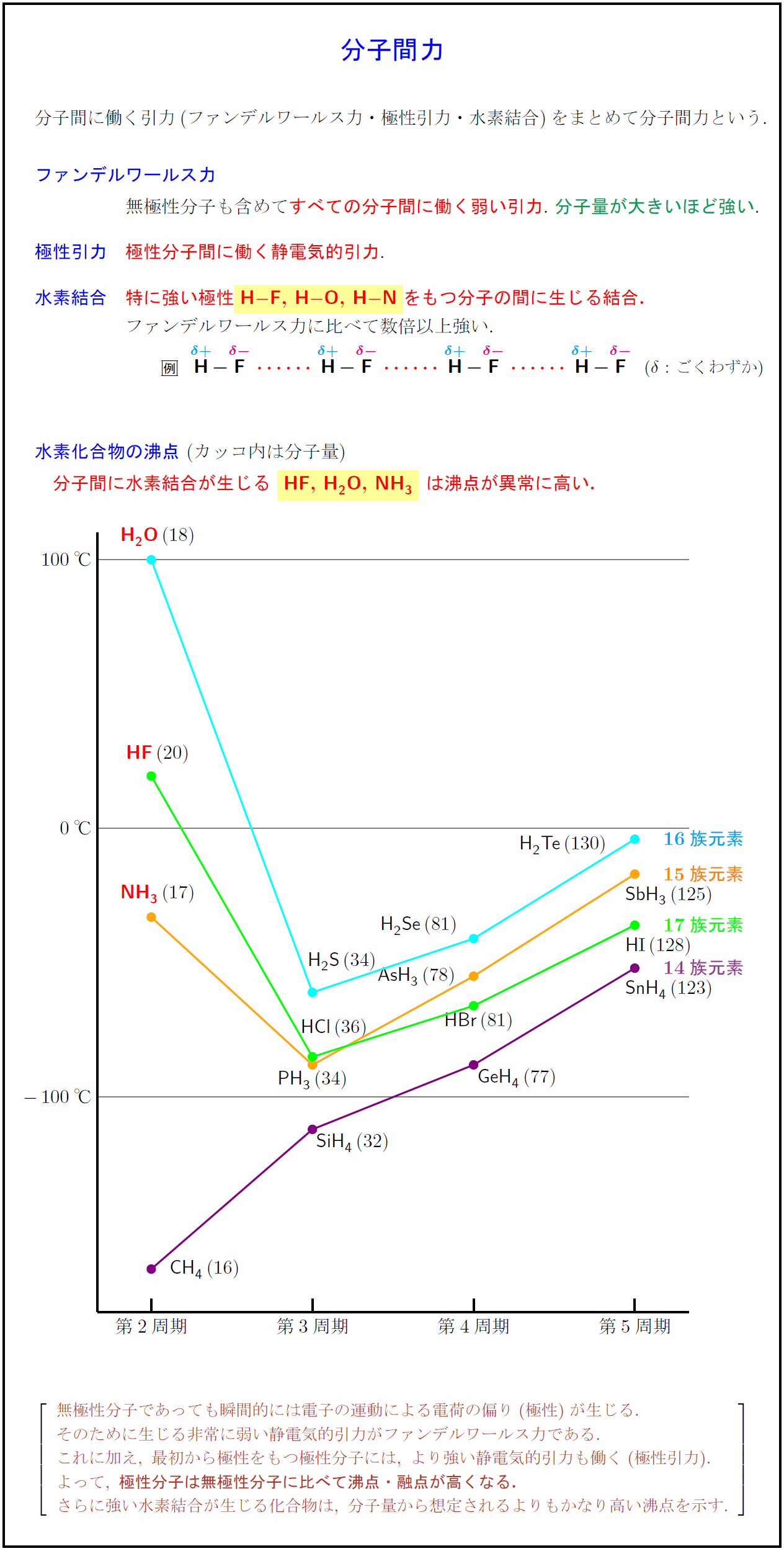
分子間に働く引力(ファンデルワールス力・極性引力・水素結合)をまとめて分子間力という.} ファンデルワールス力 無極性分子も含めてすべての分子間に働く弱い引力.\ 分子量が大きいほど強い. 極性引力 極性分子間に働く静電気的引力. 水素結合 特に強い極性yellow}{.4}{dyellow}dyellow}H-F}, {H-O}, {H-Nをもつ分子の間に生じる結合. ファンデルワールス力に比べて数倍以上強い. 水素化合物の沸点\ (カッコ内は分子量) 分子間に水素結合が生じる\ yellow}{.4}{dyellow}dyellow}HF},\ H₂O,\ NH₃}\ は沸点が異常に高い.14族元素15族元素17族元素16族元素第2周期} {(-3,-18)}[s]{第3周期} {(3,-18)}[s]{第4周期} {(9,-18)}[s]{第5周期} 無極性分子であっても瞬間的には電子の運動による電荷の偏り(極性)が生じる. そのために生じる非常に弱い静電気的引力がファンデルワールス力である. これに加え,\ 最初から極性をもつ極性分子には,\ より強い静電気的引力も働く(極性引力). よって,\ {極性分子は無極性分子に比べて沸点・融点が高くなる.} さらに強い水素結合が生じる化合物は,\ 分子量から想定されるよりもかなり高い沸点を示す.

