硫化物沈殿が酸性条件と中性・塩基性条件で変わる原理は理論化学で学習した。
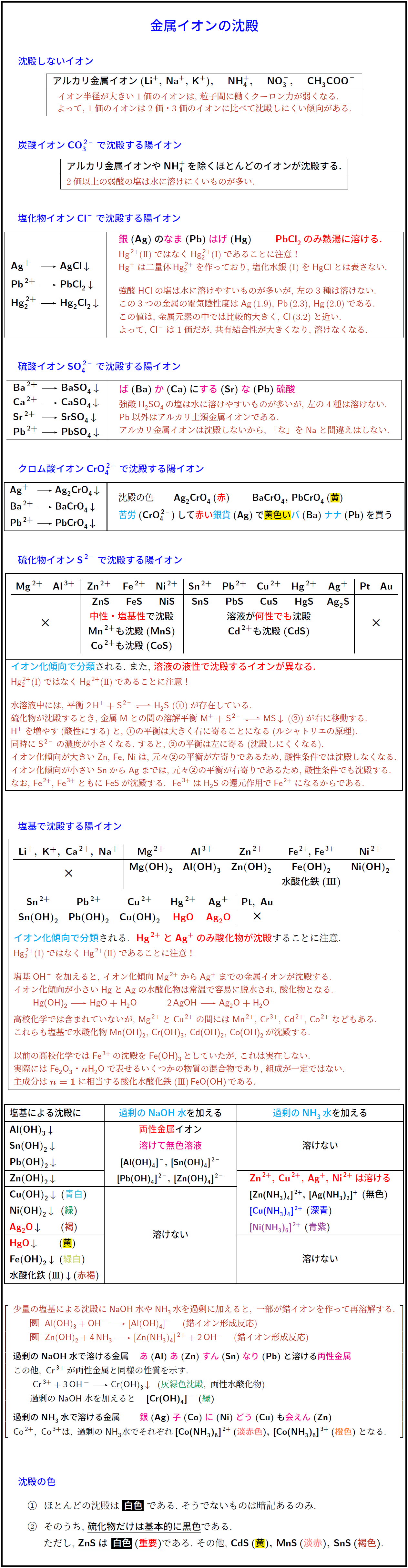
沈殿しないイオンアルカリ金属イオン(\ce{Li+},\ \ce{Na+},\ \ce{K+}), \ce{NH4+}, \ce{NO3-}, \ce{CH3COO-イオン半径が大きい1価のイオンは,\ 粒子間に働くクーロン力が弱くなる.}}よって,\ 1価のイオンは2価・3価のイオンに比べて沈殿しにくい傾向がある炭酸イオン\ce{CO3^2-}で沈殿する陽イオンアルカリ金属イオンや\ce{NH4+}\,を除くほとんどのイオンが沈殿する.}2価以上の弱酸の塩は水に溶けにくいものが多い.}} \\\hline
塩化物イオン\ce{Cl-}で沈殿する陽イオン\ce{Ag+} & \ce{->} & \ce{AgCl v} \\[.4zh]
\ce{Pb^2+} & \ce{->} & \ce{PbCl2 v} \\[.4zh]
\ce{Hg2^2+} & \ce{->} & \ce{Hg2Cl2 v}
銀}(\ce{Ag})の\textcolor{magenta}{なま}(\ce{Pb})\textcolor{magenta}{はげ}(\ce{Hg})} \textbf{\textcolor{red}{\ce{PbCl2}\,のみ熱湯に溶ける.}} \\
{\small \textcolor{BrickRed}{\ce{Hg^2+}(I\hspace{-.1em}I)ではなく\ce{Hg2^2+}(I)であることに注意!}} \\[-.2zh]
{\small \textcolor{BrickRed}{\ce{Hg+}は二量体\,\ce{Hg2^2+}を作っており,\ 塩化水銀(\mathRM{I})を\ce{HgCl}とは表さない.}} \\[1zh]
{\small \textcolor{BrickRed}{強酸\ce{HCl}の塩は水に溶けやすいものが多いが,\ 左の3種は溶けない.}} \\[-.2zh]
{\small \textcolor{BrickRed}{この3つの金属の電気陰性度は\ce{Ag}\,(1.9),\ \ce{Pb}\,(2.3),\ \ce{Hg}\,(2.0)である.}} \\[-.2zh]
{\small \textcolor{BrickRed}{この値は,\ 金属元素の中では比較的大きく,\ \ce{Cl}\,(3.2)と近い.}} \\[-.2zh]
{\small \textcolor{BrickRed}{よって,\ \ce{Cl-}は1価だが,\ 共有結合性が大きくなり,\ 溶けなくなる.硫酸イオン\ce{SO4^2-}で沈殿する陽イオン}} \\[.5zh]
\ce{Ba^2+} & \ce{->} & \ce{BaSO4 v} \\
\ce{Ca^2+} & \ce{->} & \ce{CaSO4 v} \\
\ce{Sr^2+} & \ce{->} & \ce{SrSO4 v} \\
\ce{Pb^2+} & \ce{->} & \ce{PbSO4 v} \\
ば}(\ce{Ba})\textcolor{magenta}{か}(\ce{Ca})に\textcolor{magenta}{する}(\ce{Sr})\textcolor{magenta}{な}(\ce{Pb})\textcolor{magenta}{硫酸}} \\
{\small \textcolor{BrickRed}{強酸\ce{H2SO4}\,の塩は水に溶けやすいものが多いが,\ 左の4種は溶けない.}} \\[-.2zh]
{\small \textcolor{BrickRed}{\ce{Pb}以外はアルカリ土類金属イオンである.}} \\[-.2zh]
{\small \textcolor{BrickRed}{アルカリ金属イオンは沈殿しないから,\ 「な」を\ce{Na}と間違えはしない.}}
Ag+} & \ce{->} & \ce{Ag2CrO4 v} \\[.2zh]
\ce{Ba^2+} & \ce{->} & \ce{BaCrO4 v} \\[.2zh]
\ce{Pb^2+} & \ce{->} & \ce{PbCrO4 v}
沈殿の色 \textbf{\ce{Ag2CrO4}\,(\textcolor{red}{赤}) \ce{BaCrO4},\ \ce{PbCrO4}黄苦労}(\ce{CrO4^2-})して\textcolor{red}{赤い}\textcolor{cyan}{銀貨}(\ce{Ag})で\setlength{\fboxsep}{0pt}\colorbox{yellow}{黄色い}\textcolor{cyan}{バ}(\ce{Ba})\textcolor{cyan}{ナナ}(\ce{Pb})を買う}
硫化物イオン\ce{S^2-}で沈殿する陽イオン}} \\[.5zh]
ZnS}\ \ & \ce{FeS} & \ce{NiS} & \ce{SnS} & \ce{PbS} & \ce{CuS} & \ce{HgS} & \ce{Ag2S塩基性}で沈殿} & \multicolumn{5}{c|}{溶液が\textcolor{red}{何性でも}沈殿Mn^2+}も沈殿(\ce{MnS})} & \multicolumn{5}{c|}{\ce{Cd^2+}も沈殿(\ce{CdS})} Co^2+}も沈殿(\ce{CoSイオン化傾向で分類}}される.\ また,\ \textbf{\textcolor{red}{溶液の液性で沈殿するイオンが異なる.Hg2^2+}(I)ではなく\ce{Hg^2+}(I\hspace{-.1em}I)であることに注意!水溶液中には,\ 平衡\ \ce{2H+ + S^2- <=> H2S}\ (\maru1)が存在している.硫化物が沈殿するとき,\ 金属\ce{M}との間の溶解平衡\ \ce{M+ + S^2- <=> MS v}\ (\maru2)が右に移動する.H+}を増やす(酸性にする)と,\ \maru1の平衡は大きく右に寄ることになる(ルシャトリエの原理).}}} 同時に\ce{S^2-}の濃度が小さくなる.\ すると,\ \maru2の平衡は左に寄る(沈殿しにくくなる).イオン化傾向が大きい\ce{Zn},\ \ce{Fe},\ \ce{Ni}は,\ 元々\maru2の平衡が左寄りであるため,\ 酸性条件では沈殿しなくなる.イオン化傾向が小さい\ce{Sn}から\ce{Ag}までは,\ 元々\maru2の平衡が右寄りであるため,\ 酸性条件でも沈殿する.Fe^2+},\ \ce{Fe^3+}ともに\ce{FeS}が沈殿する.\ \ \ce{Fe^3+}は\ce{H2S}の還元作用で\ce{Fe^2+}になるからである.}}}
塩基で沈殿する陽イオンMg(OH)2} & \ce{Al(OH)3} & \ce{Zn(OH)2} & \ce{Fe(OH)2} & \ce{Ni(OH)2} \\
&&&& 水酸化鉄(\textbf{I\hspace{-.1em}I\hspace{-.1em}I}) & \\
\ce{Sn^2+} & \ce{Pb^2+} & \ce{Cu^2+} & \ce{Hg^2+} & \ce{Ag+} & \ce{Pt},\ \ce{Au} \\ \hline
\ce{Sn(OH)2} & \ce{Pb(OH)2} & \ce{Cu(OH)2} & \textcolor{red}{\ce{HgO}} & \textcolor{red}{\ce{Ag2Oイオン化傾向で分類}}される.\ \ \textbf{\textcolor{red}{\ce{Hg^2+}と\ce{Ag+}のみ酸化物が沈殿}}することに注意.}{Hg2^2+}(I)ではなく\ce{Hg^2+}(I\hspace{-.1em}I)であることに注意!塩基\ce{OH-}を加えると,\ イオン化傾向\ce{Mg^2+}から\ce{Ag+}までの金属イオンが沈殿する.イオン化傾向が小さい\ce{Hg}と\ce{Ag}の水酸化物は常温で容易に脱水され,\ 酸化物となるHg(OH)2 -> HgO + H2O} \ce{2AgOH -> Ag2O + H2O高校化学では含まれていないが,\ \ce{Mg^2+}と\ce{Cu^2+}の間には\ce{Mn^2+},\ \ce{Cr^3+},\ \ce{Cd^2+},\ \ce{Co^2+}などもある.これらも塩基で水酸化物\ce{Mn(OH)2},\ \ce{Cr(OH)3},\ \ce{Cd(OH)2},\ \ce{Co(OH)2}\,が沈殿する.以前の高校化学では\ce{Fe^3+}\,の沈殿を\ce{Fe(OH)3}\,としていたが,\ これは実在しない.実際には\ce{Fe2O3}・$n$\ce{H2O}で表せるいくつかの物質の混合物であり,\ 組成が一定ではない.{主成分は$n=1$に相当する酸化水酸化鉄(I\hspace{-.1em}I\hspace{-.1em}I)\,\ce{FeO(OH)}\,である.
塩基による沈殿に & \textcolor{cyan}{過剰の\ce{NaOH}水}を加える & \textcolor{cyan}{過剰の\ce{NH3}\,水}を加える \\ \hline
\ce{Al(OH)3 v} & \multirow{4}*{
$\begin{array}{c}
\textcolor{red}{両性金属}イオン \\
\textcolor{magenta}{溶けて無色溶液} \\
{\small \textbf{\ce{[Al(OH)4]-},\ \ce{[Sn(OH)4]^2-}}} \\
{\small \textbf{\ce{[Pb(OH)4]^2-},\ \ce{[Zn(OH)4]^2-}}}
\end{array}$
} & \multirow{3}*{\textbf{溶けない}} \\
\ce{Sn(OH)2 v} & & \\
\ce{Pb(OH)2 v}n(OH)2
\textbf{\textcolor{red}{\ce{Zn^2+},\ \ce{Cu^2+},\ \ce{Ag+},\ \ce{Ni^2+}は溶ける}} \\
\textbf{{\small \ce{[Zn(NH3)4]^2+},\ \ce{[Ag(NH3)2]+}}\ (\textbf{無色})} \\
\textcolor{blue}{\textbf{{\small \ce{[Cu(NH3)4]^2+}}}}\ (\textbf{\textcolor{blue}{深青}}) \\
\textcolor{Purple}{\textbf{{\small \ce{[Ni(NH3)6]^2+}}}}\ (\textbf{\textcolor{Purple}{青紫}})
青白}) & \multirow{6}*{\textbf{溶けない}} & \\
\ce{Ni(OH)2 緑}) & & \\
\textcolor{red}{\ce{Ag2O}} \ce{ v} \ \ \ (\textcolor[named]{BrickRed}{褐}) & & \\
HgO黄}}) & & \multirow{3}*{\textbf{溶けない}} \\
\ce{Fe(OH)2 緑白}) & & \\
水酸化鉄赤褐}
少量の塩基による沈殿に\ce{NaOH}水や\ce{NH3}\,水を過剰に加えると,\ 一部が錯イオンを作って再溶解する. \\[.4zh]
\rei\ \ \ce{Al(OH)3 + OH- -> [Al(OH)4]-} (錯イオン形成反応) \\[.4zh]
\rei\ \ \ce{Zn(OH)2 + 4NH3 -> [Zn(NH3)4]^2+ + 2OH-} (錯イオン形成反応) \\[1zh]
\textcolor{black}{\textbf{過剰の\ce{NaOH}水で溶ける金属} \bm{\textcolor{magenta}{あ}(\ce{Al})\textcolor{magenta}{あ}(\ce{Zn})\textcolor{magenta}{すん}(\ce{Sn})\textcolor{magenta}{なり}(\ce{Pb})と溶ける\textcolor{magenta}{両性金属}}} \\[.4zh]
\textcolor{black}{この他,\ \ce{Cr^3+}\,が両性金属と同様の性質を示す.} \\[.4zh]
\textcolor{black}{\ce{Cr^3+ + 3OH^- -> Cr(OH)3 v}\ \ (\textcolor[named]{ForestGreen}{灰緑色沈殿},\ 両性水酸化物)} \\[.4zh]
\textcolor{black}{過剰の\ce{NaOH}水を加えると \textbf{\ce{[Cr(OH)4]^-}\ (\textcolor[named]{ForestGreen}{緑})}} \\[1zh]
\textcolor{black}{\textbf{過剰の\ce{NH3}\,水で溶ける金属} \bm{\textcolor{magenta}{銀}(\ce{Ag})\textcolor{magenta}{子}(\ce{Co})\textcolor{magenta}{に}(\ce{Ni})\textcolor{magenta}{どう}(\ce{Cu})も\textcolor{magenta}{会えん}(\ce{Zn})}} \\[.4zh]
\textcolor{black}{\ce{Co^2+},\ \ce{Co^3+}は,\ 過剰の\ce{NH3}水でそれぞれ\textbf{\ce{[Co(NH3)6]^2+}\,淡赤色}),\ \ce{[Co(NH3)6]^3+}\,(\textcolor{orange}{橙色})}となる.}沈殿の色}} \\[1zh]
\maru1\ \ ほとんどの沈殿は\ 白色}}}\ である.\ そうでないものは暗記あるのみ. \\[.7zh]
\maru2\ \ そのうち,\硫化物だけは基本的に黒色}}}である. \\[.2zh]
\ \ ただし,ZnS}は白色}}\,(\textcolor{red}{重要})}}}}である.\ その他,\ \textbf{\ce{CdS}\,黄}),\ \ce{MnS}淡赤}),\ \ce{SnS}\,褐色}


