硫化物沈殿が酸性条件と中性・塩基性条件で変わる原理は理論化学で学習した。
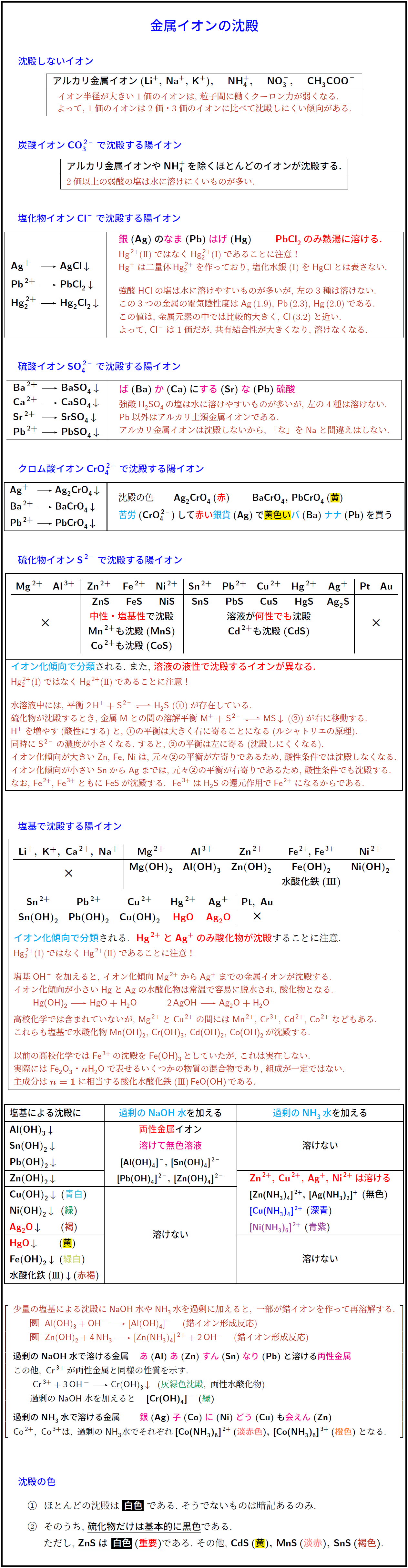
沈殿しないイオン
アルカリ金属イオン(Li⁺, Na⁺, K⁺), NH₄⁺, NO₃⁻, CH₃COO⁻
イオン半径が大きい1価のイオンは, 粒子間に働くクーロン力が弱くなる.
よって, 1価のイオンは2価・3価のイオンに比べて沈殿しにくい傾向がある.
炭酸イオンCO₃²⁻で沈殿する陽イオン
アルカリ金属イオンやNH₄⁺を除くほとんどのイオンが沈殿する.
2価以上の弱酸の塩は水に溶けにくいものが多い.
塩化物イオンCl⁻で沈殿する陽イオン
Ag⁺ → AgCl↓
Pb²⁺ → PbCl₂↓
Hg₂²⁺ → Hg₂Cl₂↓
銀(Ag)のなま(Pb)はげ(Hg) PbCl₂のみ熱湯に溶ける.
Hg²⁺(Ⅱ)ではなくHg₂²⁺(Ⅰ)であることに注意!
Hg⁺は二量体Hg₂²⁺を作っており, 塩化水銀(Ⅰ)をHgClとは表さない.
強酸HClの塩は水に溶けやすいものが多いが, 左の3種は溶けない.
これら3つの金属の電気陰性度はAg(1.9), Pb(2.3), Hg(2.0)である.
この値は金属元素の中では比較的大きく, Cl(3.2)と近い.
よって, Cl⁻は1価だが共有結合性が大きくなり溶けなくなる.
硫酸イオンSO₄²⁻で沈殿する陽イオン
Ba²⁺ → BaSO₄↓
Ca²⁺ → CaSO₄↓
Sr²⁺ → SrSO₄↓
Pb²⁺ → PbSO₄↓
ば(Ba)か(Ca)にする(Sr)な(Pb)硫酸
強酸H₂SO₄の塩は水に溶けやすいものが多いが, 左の4種は溶けない.
Pb以外はアルカリ土類金属イオンである.
アルカリ金属イオンは沈殿しないから, 「な」をNaと間違えはしない.
クロム酸イオンCrO₄²⁻で沈殿する陽イオン
Ag⁺ → Ag₂CrO₄↓
Ba²⁺ → BaCrO₄↓
Pb²⁺ → PbCrO₄↓
沈殿の色:Ag₂CrO₄(赤), BaCrO₄・PbCrO₄(黄)
苦労(CrO₄²⁻)して赤い銀貨(Ag)で黄色いバ(Ba)ナナ(Pb)を買う.
硫化物イオンS²⁻で沈殿する陽イオン
Mg²⁺, Al³⁺, Zn²⁺, Fe²⁺, Ni²⁺, Sn²⁺, Pb²⁺, Cu²⁺, Hg²⁺, Ag⁺, Pt, Au
Mg²⁺, Al³⁺は沈殿しない(×).
ZnS, FeS, NiS, SnS, PbS, CuS, HgS, Ag₂Sが沈殿する.
ZnS, FeS, NiS, MnS, CoSは中性・塩基性で沈殿.
SnS, PbS, CuS, HgS, Ag₂S, CdSは溶液が何性でも沈殿.
Pt, Auは沈殿しない(×).
イオン化傾向で分類される. また, 溶液の液性で沈殿するイオンが異なる.
Hg₂²⁺(Ⅰ)ではなくHg²⁺(Ⅱ)であることに注意!
水溶液中には, 平衡 2H⁺ + S²⁻ ⇌ H₂S (①) が存在している.
硫化物が沈殿するとき, 金属Mとの間の溶解平衡 M⁺ + S²⁻ ⇌ MS↓ (②) が右に移動する.
H⁺を増やす(酸性にする)と, ①の平衡は右に寄る(ルシャトリエの原理).
同時にS²⁻の濃度が小さくなる. すると, ②の平衡は左に寄り沈殿しにくくなる.
イオン化傾向が大きいZn, Fe, Niは, もともと②の平衡が左寄りであるため, 酸性条件では沈殿しなくなる.
イオン化傾向が小さいSnからAgまでは, もともと②の平衡が右寄りであるため, 酸性条件でも沈殿する.
なお, Fe²⁺, Fe³⁺ともにFeSが沈殿する. Fe³⁺はH₂Sの還元作用でFe²⁺になるからである.
塩基で沈殿する陽イオン
Li⁺, K⁺, Ca²⁺, Na⁺は沈殿しない(×).
Mg(OH)₂, Al(OH)₃, Zn(OH)₂, Fe(OH)₂, Fe(OH)₃, Ni(OH)₂ などが沈殿する.
Sn(OH)₂, Pb(OH)₂, Cu(OH)₂, HgO(黄), Ag₂O(褐) は沈殿.
Pt, Au は沈殿しない(×).
イオン化傾向で分類される. Hg²⁺とAg⁺のみ酸化物が沈殿することに注意.
Hg₂²⁺(Ⅰ)ではなくHg²⁺(Ⅱ)であることに注意!
塩基OH⁻を加えると, Mg²⁺〜Ag⁺の金属イオンが沈殿する.
イオン化傾向が小さいHgとAgの水酸化物は常温で容易に脱水され酸化物となる.
Hg(OH)₂ → HgO + H₂O
2AgOH → Ag₂O + H₂O
高校化学では含まれていないが, Mg²⁺とCu²⁺の間にはMn²⁺, Cr³⁺, Cd²⁺, Co²⁺などもある.
これらも塩基で水酸化物Mn(OH)₂, Cr(OH)₃, Cd(OH)₂, Co(OH)₂が沈殿する.
以前の高校化学ではFe³⁺の沈殿をFe(OH)₃としていたが, これは実在しない.
実際にはFe₂O₃・nH₂Oで表せるいくつかの物質の混合物であり, 組成が一定ではない.
主成分はn=1に相当する酸化水酸化鉄(Ⅲ)FeO(OH)である.
塩基による沈殿に過剰のNaOH水やNH₃水を加えると, 一部が錯イオンを作って再溶解する.
例:
Al(OH)₃ + OH⁻ → [Al(OH)₄]⁻
Zn(OH)₂ + 4NH₃ → [Zn(NH₃)₄]²⁺ + 2OH⁻
過剰NaOH水で溶ける金属 あ(Al) あ(Zn) すん(Sn) なり(Pb)と溶ける両性金属
このほか, Cr³⁺も両性金属と同様の性質を示す.
Cr³⁺ + 3OH⁻ → Cr(OH)₃↓ (灰緑色沈殿, 両性水酸化物)
過剰NaOH水を加えると [Cr(OH)₄]⁻ (緑).
過剰NH₃水で溶ける金属 銀(Ag) 子(Co) に(Ni) どう(Cu)も 会えん(Zn)
Co²⁺, Co³⁺は過剰NH₃水でそれぞれ[Co(NH₃)₆]²⁺(淡赤色), [Co(NH₃)₆]³⁺(橙色)となる.
沈殿の色
ほとんどの沈殿は白色である. そうでないものは暗記する.
そのうち, 硫化物だけは基本的に黒色である.
ただし, ZnSは白色(重要). その他, CdSは黄, MnSは淡赤, SnSは褐色.

