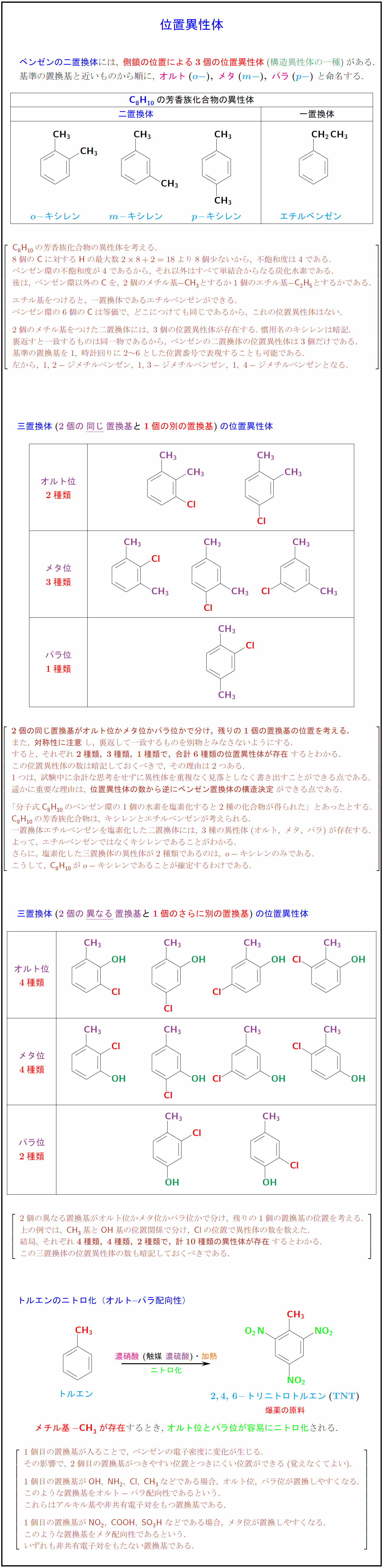
ベンゼンの二置換体には,\ 側鎖の位置による3個の位置異性体(構造異性体の一種})がある.$} $基準の置換基と近いものから順に,\ {オルト}(o-}),\ メタ}(m-}),\ パラ}(p-})}$\ と命名する. {C8H_{10}の芳香族化合物の異性体 二置換体 一置換体} {o}$–キシレン {m}$–キシレン ${p}$–キシレン エチルベンゼン {C8H10}の芳香族化合物の異性体を考える. 8個の{C}に対する{H}の最大数28+2=18より8個少ないから,\ 不飽和度は4である. ベンゼン環の不飽和度が4であるから,\ それ以外はすべて単結合からなる炭化水素である. 後は,\ ベンゼン環以外の{C}を,\ 2個のメチル基{- CH₃}とするか1個のエチル基{- C₂H₅}とするかである. エチル基をつけると,\ 一置換体であるエチルベンゼンができる. ベンゼン環の6個の{C}は等価で,\ どこにつけても同じであるから,\ これの位置異性体はない. 2個のメチル基をつけた二置換体には,\ 3個の位置異性体が存在する.\ 慣用名のキシレンは暗記. 裏返すと一致するものは同一物であるから,\ ベンゼンの二置換体の位置異性体は3個だけである. 基準の置換基を1,\ 時計回りに2~6とした位置番号で表現することも可能である. 左から,\ 1,2-ジメチルベンゼン,\ 1,3-ジメチルベンゼン,\ 1,\ 4-ジメチルベンゼンとなる. 三置換体(2個の同じ}置換基}と1個の別の置換基})}の位置異性体オルト位 メタ位 3種類 パラ位} {2個の同じ置換基がオルト位かメタ位かパラ位かで分け,\ 残りの1個の置換基の位置を考える.} また,\ {対称性に注意}し,\ 裏返して一致するものを別物とみなさないようにする. すると,\ それぞれ{2種類,\ 3種類,\ 1種類で,\ 合計6種類の位置異性体が存在}するとわかる. この位置異性体の数は暗記しておくべきで,\ その理由は2つある. 1つは,\ 試験中に余計な思考をせずに異性体を重複なく見落としなく書き出すことができる点である. 遥かに重要な理由は,\ {位置異性体の数から逆にベンゼン置換体の構造決定}ができる点である. 「分子式{C8H10}のベンゼン環の1個の水素を塩素化すると2種の化合物が得られた」とあったとする. {C8H10}の芳香族化合物は,\ キシレンとエチルベンゼンが考えられる. 一置換体エチルベンゼンを塩素化した二置換体には,\ 3種の異性体(オルト,\ メタ,\ パラ)が存在する. よって,\ エチルベンゼンではなくキシレンであることがわかる. さらに,\ 塩素化した三置換体の異性体が2種類であるのは,\ o-キシレンのみである. こうして,\ {C8H10}がo-キシレンであることが確定するわけである. 三置換体(2個の異なる}置換基}と1個のさらに別の置換基})}の位置異性体{オルト位 メタ位 パラ位 2個の異なる置換基がオルト位かメタ位かパラ位かで分け,\ 残りの1個の置換基の位置を考える. 上の例では,\ {CH₃}基と{OH}基の位置関係で分け,\ {Cl}の位置で異性体の数を数えた. 結局,\ それぞれ{4種類,\ 4種類,\ 2種類で,\ 計10種類の異性体が存在}するとわかる. この三置換体の位置異性体の数も暗記しておくべきである. トルエンのニトロ化(オルト–パラ配向性) [1.5zh] トルエン \2,4,\ 6–トリニトロトルエン}(TNT})} 爆薬の原料} 濃硝酸}\ (触媒\ 濃硫酸})・加熱}ニトロ化 {メチル基{- CH₃}が存在するとき, オルト位とパラ位が容易にニトロ化される. $[l} 1個目の置換基が入ることで,\ ベンゼンの電子密度に変化が生じる. その影響で,\ 2個目の置換基がつきやすい位置とつきにくい位置ができる(覚えなくてよい). 1個目の置換基が{OH},\ {NH₂},\ {Cl},\ {CH₃}などである場合,\ オルト位,\ パラ位が置換しやすくなる. このような置換基をオルト-パラ配向性であるという. これらはアルキル基や非共有電子対をもつ置換基である. 1個目の置換基が{NO₂},\ {COOH},\ {SO₃H}\ などである場合,\ メタ位が置換しやすくなる. このような置換基をメタ配向性であるという. いずれも非共有電子対をもたない置換基である.

