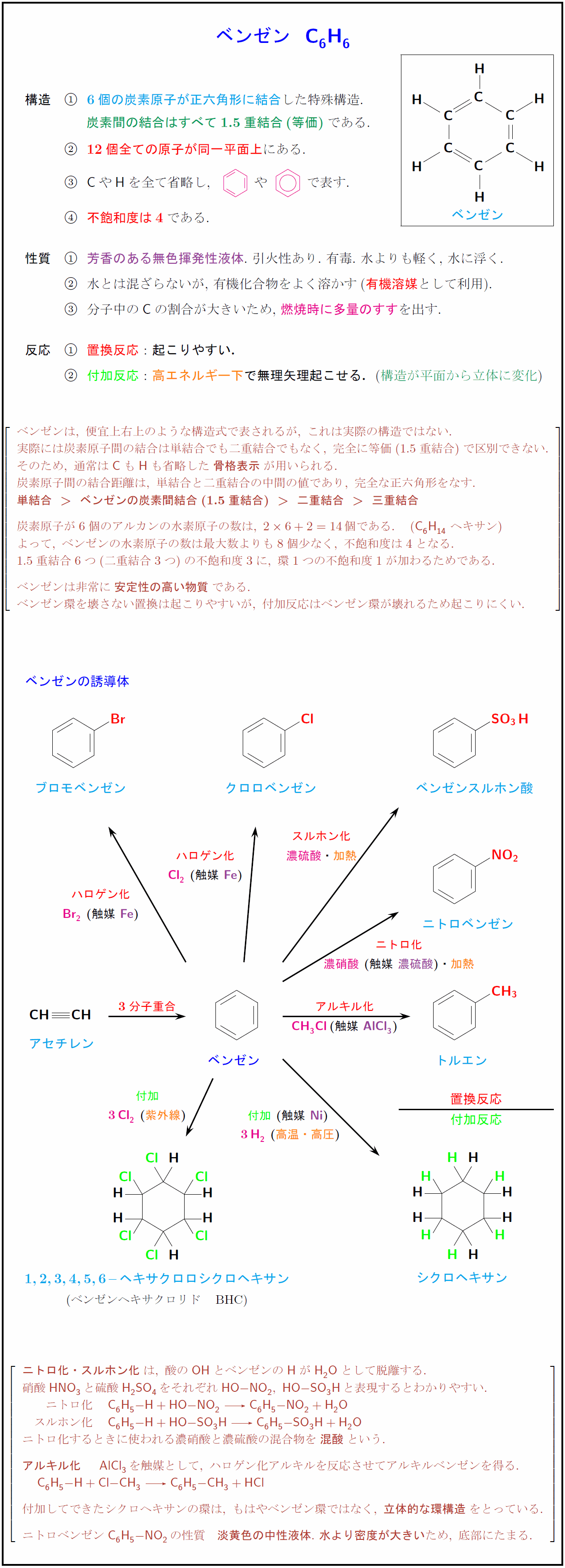
6個の炭素原子が正六角形に結合した特殊構造. 炭素間の結合はすべて1.5重結合(等価)である. 12個全ての原子が同一平面上にある. [-.5zh] {C}や{H}を全て省略し 不飽和度は4である. 芳香のある無色揮発性液体.\ 引火性あり.\ 有毒.\ 水よりも軽く,\ 水に浮く. 水とは混ざらないが,\ 有機化合物をよく溶かす(有機溶媒として利用). 分子中の{C}の割合が大きいため,\ 燃焼時に多量のすすを出す. 反応} {置換反応}:起こりやすい.} 付加反応}:高エネルギー下}で無理矢理起こせる.}(構造が平面から立体に変化}) ベンゼンは,\ 便宜上右上のような構造式で表されるが,\ これは実際の構造ではない. 実際には炭素原子間の結合は単結合でも二重結合でもなく,\ 完全に等価(1.5重結合)で区別できない. そのため,\ 通常は{C}も{H}も省略した{骨格表示}が用いられる. 炭素原子間の結合距離は,\ 単結合と二重結合の中間の値であり,\ 完全な正六角形をなす. {単結合\ ベンゼンの炭素間結合(1.5重結合)二重結合\ 三重結合} 炭素原子が6個のアルカンの水素原子の数は,\ 26+2=14個である. ({C6H14}\ ヘキサン) よって,\ ベンゼンの水素原子の数は最大数よりも8個少なく,\ 不飽和度は4となる. 1.5重結合6つ(二重結合3つ)の不飽和度3に,\ 環1つの不飽和度1が加わるためである. ベンゼンは非常に{安定性の高い物質}である. ベンゼン環を壊さない置換は起こりやすいが,\ 付加反応はベンゼン環が壊れるため起こりにくい. ベンゼンの誘導体 ₀ アセチレン \ベンゼン ベンゼンスルホン酸 クロロベンゼン \ブロモベンゼン \ニトロベンゼン トルエン 1,2,3,4,5,6–ヘキサクロロシクロヘキサン (ベンゼンヘキサクロリド BHC)} シクロヘキサン 高温・高圧ニトロ化}濃硝酸} スルホン化濃硫酸}{加熱ハロゲン化紫外線}置換反応付加反応} 3分子重合}アルキル化}触媒\ {ニトロ化・スルホン化}は,\ 酸の{OH}とベンゼンの{H}がH₂Oとして脱離する. 硝酸{HNO₃}と硫酸{H₂SO₄}をそれぞれ{HO-NO₂},\ {HO-SO₃H}と表現するとわかりやすい. ニトロ化 {C₆H₅-H + HO-NO₂ C₆H₅-NO₂ + H₂O} スルホン化 {C₆H₅-H + HO-SO₃H C₆H₅-SO₃H + H₂O} ニトロ化するときに使われる濃硝酸と濃硫酸の混合物を{混酸}という. {アルキル化} {AlCl3}を触媒として,\ ハロゲン化アルキルを反応させてアルキルベンゼンを得る. {C₆H₅-H + Cl-CH₃ C₆H₅-CH₃ + HCl} 付加してできたシクロヘキサンの環は,\ もはやベンゼン環ではなく,\ {立体的な環構造}をとっている. ニトロベンゼン{C₆H₅-NO₂}の性質 淡黄色の中性液体}.\ 水より密度が大きい}ため,\ 底部にたまる.

