多数の$\bm{\alpha}$\,–\,アミノ酸が結合した高分子化合物(ポリペプチド)}}をタンパク質}}(蛋白質)といい, \\[.2zh]
\textbf{生命活動において重要な役割}を担っている(人体は水分50\,~\,70\%,\ タンパク質15\,~\,20\%). \\[.2zh]
\textbf{各タンパク質ごとに一定の$\bm{\alpha}$\,–\,アミノ酸の数・種類・配列順序}をもち,\ 各生物がもつ \\[.2zh]
DNAに記録されているアミノ酸配列情報に従って合成される. \\[.2zh]
炭水化物,\ 脂質と並ぶ\textbf{\textcolor{Purple}{三大栄養素}}の1つで,\ 卵,\ 肉類,\ 大豆などに多く含まれる.
多くのタンパク質は,\ 構成アミノ酸が100個以上で,\ 分子量は1万\,~\,数百万にもなる. \\[.2zh]
\alpha\,\text{–}\,アミノ酸は約20種類あるため,\ アミノ酸の種類や配列順序でタンパク質の種類は膨大になる. \\[.2zh]
ヒトの体内だけでも10万種類のタンパク質があるとされる. \\[1zh]
初めてアミノ酸配列順序がわかったタンパク質はウシの膵臓に含まれるインスリンである(1955年). \\[.2zh]
\alpha\,\text{–}\,アミノ酸51個(分子量5735)と小さいタンパク質だが,\ 配列順序の確定に10年の歳月を要した. \\[.2zh]
インスリンは血糖値を下げる働きをもつホルモンで,\ 分泌や働きが悪化すると糖尿病になる.
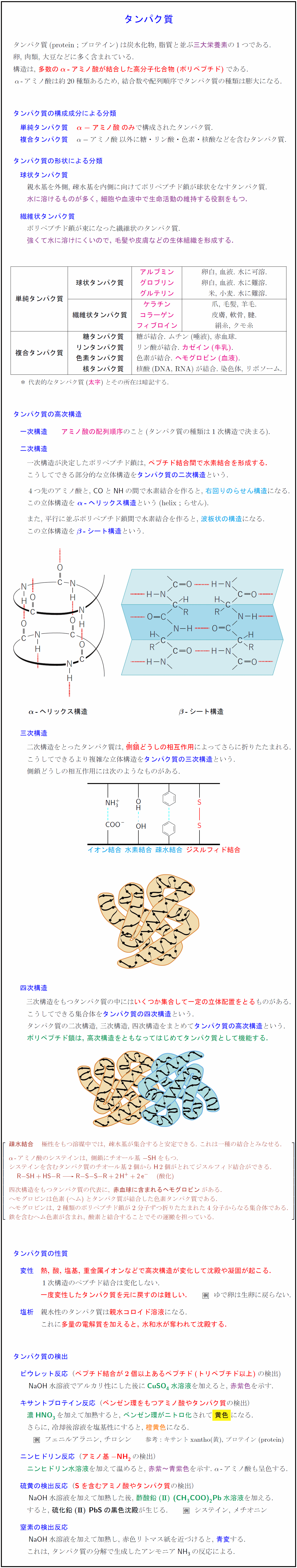
タンパク質の高次構造}アミノ酸の配列順序}}のこと(タンパク質の種類は1次構造で決まる)
一次構造が決定したポリペプチド鎖は,\ \textbf{\textcolor{red}{ペプチド結合間で水素結合を形成する.}} \\[.2zh]
こうしてできる部分的な立体構造を\textbf{\textcolor{blue}{タンパク質の二次構造}}という. \\[.8zh]
4つ先のアミノ酸と,\ \ce{CO}と\ce{NH}の間で水素結合を作ると,\ \textbf{\textcolor{cyan}{右回りのらせん構造}}になる. \\[.2zh]
この立体構造を\ \textbf{\textcolor{blue}{$\bm{\alpha}$\,–\,ヘリックス構造}}という(helix;らせん). \\[.8zh]
また,\ 平行に並ぶポリペプチド鎖間で水素結合を作ると,\ \textbf{\textcolor{cyan}{波板状の構造}}になる. \\[.2zh]
この立体構造を\textbf{\textcolor{blue}{$\bm{\beta}$\,–\,シート構造}}という. \\\\
$\bm{\alpha}$\textbf{\,–\,ヘリックス構造} $\bm{\beta}$\textbf{\,–\,シート構造} 二次構造をとったタンパク質は,\ \textbf{\textcolor{red}{\.{側}\.{鎖}どうしの相互作用}}によってさらに折りたたまれる. \\[.2zh]
こうしてできるより複雑な立体構造を\textbf{\textcolor{blue}{タンパク質の三次構造}}という. \\[.2zh]
側鎖どうしの相互作用には次のようなものがある. \\[1.5zh]
イオン結合水素結合疎水結合 ジスルフィド結合ポリペプチド鎖三次構造をもつタンパク質の中には\textbf{\textcolor{red}{いくつか集合して一定の立体配置をとる}}ものがある.} \\[.2zh]
こうしてできる集合体を\textbf{\textcolor{blue}{タンパク質の四次構造}}という. \\[.2zh]
タンパク質の二次構造,\ 三次構造,\ 四次構造をまとめて\textbf{\textcolor{blue}{タンパク質の高次構造}}という. \\[.2zh]
\textbf{\textcolor[named]{ForestGreen}{ポリペプチド鎖は,\ 高次構造をともなってはじめてタンパク質として機能する.}ペプチド結合のカルボニル基\ce{C=O}とイミノ基\ce{NH}は強い極性をもつため,\ 水素結合できる. \\[.2zh]
水のように極性をもつ溶媒中では,\ ファンデルワールス力によって疎水基が集合すると安定する. \\[.2zh]
これは一種の結合とみなすことができる(\bm{疎水結合}). \\[1zh]
\alpha\,\text{–}\,アミノ酸のシステインは,\ 側鎖にチオール基\ \ce{- SH}をもつ. \\[.2zh]
システインを含むタンパク質のチオール基2個から2個の\ce{H}がとれるとジスルフィド結合ができる. \\[.2zh]
\ce{R-SH + HS-R -> R-S-S-R + 2H+ + 2e-}\ \ (酸化) \\[.2zh]
\bm{共有結合}であるジスルフィド結合は,\ タンパク質の立体構造の形成や安定化に特に役立つ. \\[1zh]
四次構造をもつタンパク質の代表が,\ \bm{赤血球に含まれるヘモグロビン}である. \\[.2zh]
2種類のポリペプチド鎖(3次構造)がそれぞれ2分子ずつ合計4分子からなる集合体である. \\[.2zh]
ヘモグロビンは,\ 色素(ヘム)とタンパク質が結合した色素タンパク質である. \\[.2zh]
鉄イオン\ce{Fe^2+}を含むヘム色素は酸素と結びつきやすく,\ 全身への酸素の運搬を担っている.
タンパク質の構成成分による分類}} \\[1zh]
\textbf{\textcolor{blue}{単純タンパク質}} \textbf{\textcolor{red}{$\bm{\alpha}$\,–\,アミノ酸のみ}}で構成されたタンパク質. \\[.5zh]
\textbf{\textcolor{blue}{複合タンパク質}} $\alpha$\,–\,アミノ酸以外に糖・リン酸・色素・核酸などを含むタンパク質. タンパク質の形状による分類}球状タンパク質}} \\[.5zh]
親水基を外側,\ 疎水基を内側に向けてポリペプチド鎖が球状をなすタンパク質. \\[.2zh]
\textbf{\textcolor{Purple}{水に溶けるものが多く,\ 細胞や血液中で生命活動の維持する役割をもつ.}} \\[1zh]
\textbf{\textcolor{blue}{繊維状タンパク質}} \\[.5zh]
ポリペプチド鎖が束になった繊維状のタンパク質. \\[.2zh]
\textbf{\textcolor{Purple}{強くて水に溶けにくいので,\ 毛髪・皮膚・筋肉・内臓などの生体組織を形成する.}}単純タンパク質}} & & \textbf{\textcolor{magenta}{アルブミン}} & 卵白,\ 血液 (水に可溶) \\\cline{3-4}
& \textbf{球状タンパク質} & \textbf{\textcolor{magenta}{グロブリン}} & 卵白,\ 血液 (水に難溶) グルテリン}} & 米,\ 小麦 (水に難溶)ケラチン}} & 爪,\ 毛髪,\ 角,\ 羊毛,\ 羽毛 繊維状タンパク質} & \textbf{\textcolor{magenta}{コラーゲン}} & 皮膚,\ 軟骨,\ 歯,\ 腱,\ 魚の鱗 フィブロイン}} & 絹糸,\ クモ糸 \\\hline
\multirow{4}*{\textbf{複合タンパク質}} & \textbf{糖タンパク質} & 糖が結合.\ ムチン(だ液)}},\ 赤血球.}リンタンパク質} リン酸が結合.\ \textbf{\textcolor{magenta}{カゼイン(牛乳)}}.} 色素タンパク質} & 色素が結合.\ \textbf{\textcolor{magenta}{ヘモグロビン(血液)}}.} \\\cline{2-4}
& \textbf{核タンパク質}核酸(DNA,\ RNA)が結合.\ 染色体,\ リボソーム.} \\
毛髪のパーマの原理}} \\[1zh]
毛髪は\textbf{\textcolor{magenta}{繊維状タンパク質ケラチン}}で構成されており,\ ジスルフィド結合\ce{- S-S -}によって \\[.2zh]
一定の形が保たれている. \\[.2zh]
\textbf{\textcolor{red}{還元剤でジスルフィド結合\ce{- S-S -}を還元してチオール基\ce{- SH}として切断}}し, \\[.2zh]
好みの形に整えた後, \textbf{\textcolor{red}{酸化剤でジスルフィド結合\ce{- S-S -}を再生}}する. \\\\
ケラチン分子タンパク質の性質}} 変性}} \textbf{\textcolor{red}{熱,\ 酸,\ 塩基,\ 重金属イオンなどで高次構造が変化して沈殿や凝固が起こる.}} \\[.2zh]
一次構造のペプチド結合は変化しない. \\[.2zh]
\textbf{一度変性したタンパク質を元に戻すのは難しい.} \ \rei\ ゆで卵は生卵に戻らない. \\[.2zh]
また,\ 生理的機能を持つタンパク質は,\ 変性により機能を失う(\textbf{\textcolor{blue}{失活}}). \\\\
\textbf{\textcolor{blue}{塩析}} 水溶性のタンパク質を水に溶かすと,\ \textbf{\textcolor{red}{親水コロイド溶液}}になる. \\[.2zh]
これに\textbf{\textcolor{red}{多量の電解質を加えると,\ 水和水が奪われて沈殿する.}} \\\\
\textbf{\textcolor{blue}{透析}} 不純物を含むタンパク質の水溶液を半透膜の袋に入れて流水中に浸しておくと, \\[.2zh]
\textbf{小さな分子やイオンは半透膜外へ拡散するが,\ 大きなタンパク質分子は袋中に残る.} \\\\\\
\textbf{\textcolor{blue}{タンパク質の検出}} \\[1zh]
\textbf{\textcolor{blue}{ビウレット反応}}:\textbf{\textcolor{red}{ペプチド結合が2個以上あるペプチド(トリペプチド以上)}}の検出 \\[.5zh]
\textbf{\ce{NaOH}水溶液で塩基性}にした後にCuSO4}\,水溶液}}を加えると,\ \textbf{\textcolor{Purple}{赤紫色}}を示す. \\[.2zh]
2個のペプチド結合に1個の\ce{Cu^2+}が配位結合して錯イオンを形成するためである. \\\\
\textbf{\textcolor{blue}{キサントプロテイン反応}}:\textbf{\textcolor{red}{ベンゼン環をもつアミノ酸やタンパク質}}の検出濃硝酸\ce{HNO3}}}\,を加えて加熱すると,\ ベンゼン環がニトロ化}}されて黄色}}になる. \\[.2zh]
さらに,\ 冷却後に溶液に\textbf{\ce{NH3}\,水を加えて塩基性}にすると,\ \textbf{\textcolor{orange}{橙黄色}}になる. \\[.2zh]
\rei\ \ フェニルアラニン,\ チロシン {\small 参考:キサント\text{xantho}(黄),\ protein(タンパク質)} \\\\
\textbf{\textcolor{blue}{ニンヒドリン反応}}:\textbf{\textcolor{red}{アミノ基\ce{- NH2}}}\,の検出 \\[.5zh]
\textbf{\textcolor[named]{ForestGreen}{ニンヒドリン水溶液}}を加えて温めると,\ \textbf{\textcolor{Purple}{赤紫~青紫色}}を示す.\ \ $\alpha$\,–\,アミノ酸も呈色する. \\\\
\textbf{\textcolor{blue}{硫黄\ce{S}の検出反応}}:\textbf{\textcolor{red}{\ce{S}を含むアミノ酸やタンパク質}}の検出 \\[.5zh]
\textbf{\ce{NaOH}水溶液を加えて加熱}した後,\ 酢酸鉛(I\hspace{-.1em}I)\ \ce{(CH3COO)2Pb}水溶液}}を加える. \\[.2zh]
すると,\ \textbf{\textcolor{red}{硫化鉛(I\hspace{-.1em}I)\ \ce{PbS}の黒色}沈殿}}が生じる. \rei\ \ システイン,\ メチオニン \\\\
\textbf{\textcolor{blue}{窒素\ce{N}の検出反応}} \\[.5zh]
\textbf{\ce{NaOH}水溶液を加えて加熱}して生じた気体に\textbf{\textcolor{red}{赤色リトマス紙}}を近づけると,\ \textbf{\textcolor{blue}{青変}}する. \\[.2zh]
これは,\ タンパク質の分解で\textbf{\textcolor{red}{アンモニア\ce{NH3}}}\,(塩基性気体)が生成するためである.

