酵素 生体内の特定の化学反応において触媒の役割をもつタンパク質(生体触媒).
他の触媒と同様, 活性化エネルギーを小さくすることで反応を促進する.
また, 他物質(ビタミンが多い)と結合して初めて触媒作用を示す酵素がある.
ビタミンのように酵素を補助する低分子量の有機化合物を補酵素という.
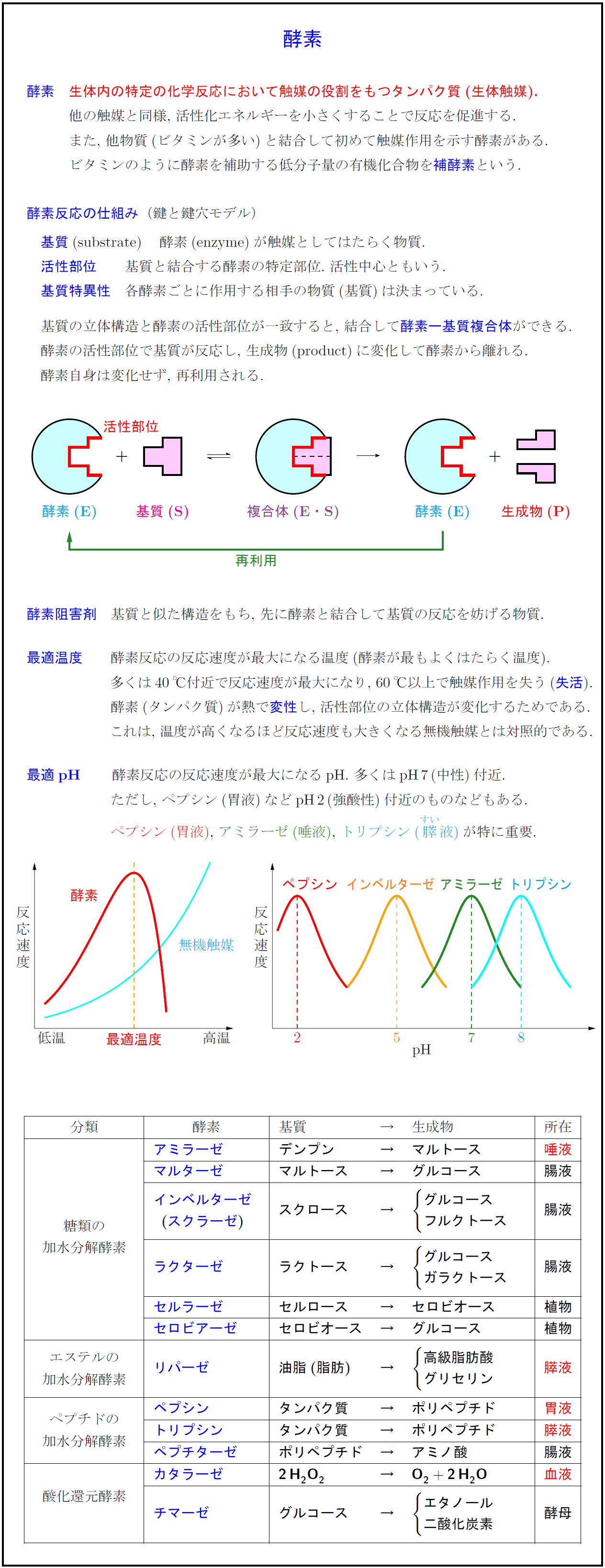
酵素反応の仕組み(鍵と鍵穴モデル)
基質(Substrate) 酵素(Enzyme)が触媒としてはたらく物質.
活性部位 基質と結合する酵素の特定部位. 活性中心ともいう.
基質特異性 各酵素ごとに作用する相手の物質(基質)は決まっている.
基質の立体構造と酵素の活性部位が一致すると, 結合して酵素ー基質複合体ができる.
酵素の活性部位で基質が反応し, 生成物(product)に変化して酵素から離れる.
酵素自身は変化せず, 再利用される.
酵素阻害剤 基質と似た構造をもち, 先に酵素と結合して基質の反応を妨げる物質.
最適温度 酵素反応の反応速度が最大になる温度(酵素が最もよくはたらく温度).
多くは40℃付近で反応速度が最大になり, 60℃以上で触媒作用を失う(失活).
酵素(タンパク質)が熱で変性し, 活性部位の立体構造が変化するためである.
これは, 温度が高くなるほど反応速度も大きくなる無機触媒とは対照的である.
最適pH 酵素反応の反応速度が最大になるpH. 多くはpH 7(中性)付近.
ただし, ペプシン(胃液)などpH 2(強酸性)付近のものなどもある.
ペプシン(胃液), アミラーゼ(唾液), トリプシン(膵液)が特に重要.
分類表:
分類|酵素|基質|→|生成物|所在
糖類の加水分解酵素:
アミラーゼ|デンプン → マルトース|唾液
マルターゼ|マルトース → グルコース|腸液
インベルターゼ(スクラーゼ)|スクロース → グルコース/フルクトース|腸液
ラクターゼ|ラクトース → グルコース/ガラクトース|腸液
セルラーゼ|セルロース → セロビオース|植物
セロビアーゼ|セロビオース → グルコース|植物
エステルの加水分解酵素:
リパーゼ|油脂(脂肪) → 高級脂肪酸/グリセリン|膵液
タンパク質の加水分解酵素:
ペプシン|タンパク質 → ポリペプチド|胃液
トリプシン|タンパク質 → ポリペプチド|膵液
ペプチターゼ|ポリペプチド → アミノ酸|腸液
酸化還元酵素:
カタラーゼ|2H₂O₂ → O₂ + 2H₂O|血液
チマーゼ|単糖類 → エタノール/二酸化炭素|酵母
酵素は, 基質の名称や反応の種類の語尾をアーゼ(-ase)に変えて名付けられていることが多い.
ペプシンとトリプシンなどのタンパク質(プロテイン)分解酵素をプロテアーゼという.
アミラーゼは, デンプンのラテン語 amylum に由来する.
リパーゼは, 脂肪のギリシャ語 lipos に由来する.
チマーゼは単一の酵素と考えられていたが, 実際には10種以上の酵素からなることが後に判明した.

