単糖類 C₆H₁₂O₆
糖類 多くが一般式 CₘH₂ₙOₙ で表される. 米やパンに多く含まれている.
Cₘ(H₂O)ₙ とも表せるので, 炭水化物(炭素と水の化合物)とも呼ばれる.
構成単位数による糖の分類
単糖 それ以上加水分解されない糖.
二糖 加水分解によって単糖2分子が生じる糖.
少糖 加水分解によって単糖2〜10分子が生じる糖. オリゴ糖ともいう.
(オリゴはギリシャ語で『少ない』の意)
多糖 加水分解によって多数の単糖が生じる糖. 高分子化合物.
代表的な単糖
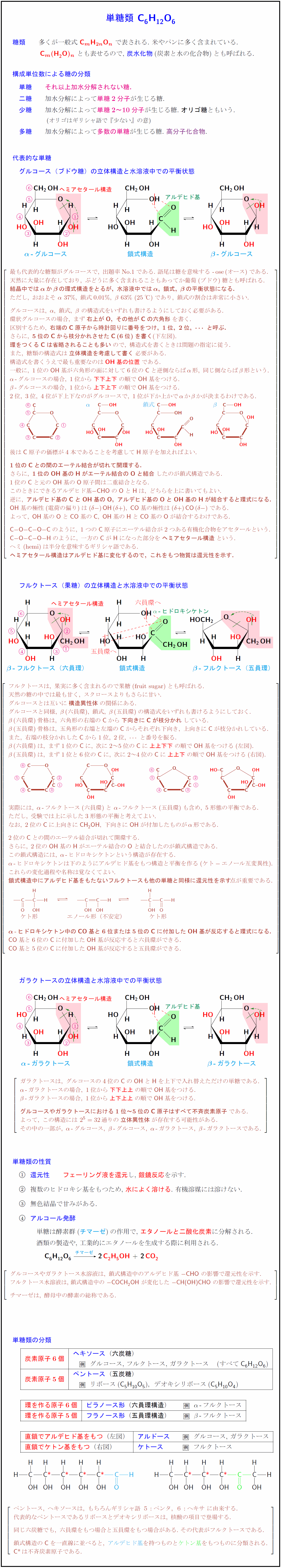
グルコース(ブドウ糖)の立体構造と水溶液中での平衡状態
最も代表的な単糖がグルコースで, 出題率 No.1 である. 語尾は糖を意味する -ose (オース)である.
天然に大量に存在しており, ぶどうに多く含まれることから葡萄(ブドウ)糖とも呼ばれる.
最も重要な生体のエネルギー源の1つである.
結晶中では α か β の環状構造をとるが, 水溶液中では α, 鎖状, β の平衡状態になる.
割合は温度によって変わるので, ここで示した数値は参考程度で覚える必要はない.
ただし, β の割合が大きいことと鎖状構造の割合が非常に小さいことは重要である.
グルコースは, α, 鎖状, β の構造式をいずれも書けるようにしておく必要がある.
環状グルコースの場合, まず右上が O, その他が C の六角形を書く.
6個の C原子を区別するため, 右端の C原子から時計回りに番号をつけ, 1位, 2位, … と呼ぶ.
さらに, 5位の C から枝分かれさせた C (6位)を書くと骨格が完成する.
環をつくる C は省略して書くことも多いので, 構造式を解答する場合は問題の指定に従う.
糖類の構造式は立体構造を考慮して書く必要があり, 4個の OH 基の立体配置が特に重要である.
一般に, 1位の OH 基が六角形の面に対して6位の C と逆側なら α形, 同じ側なら β形という.
まず β–グルコースを覚え, 他は β–グルコースとの差分として覚えることを推奨する.
「β–グルコースは1位の C から 上下上下 と交互に OH 基をつけ,
α は1位の C の上下が逆」
後は6位の C にも OH 基をつけ, 残った部分に H をつけて完成である.
1位の OH 基の H が環内の O 原子に転位すると, エーテル結合が切れ, 鎖状構造になる.
1位の CO 間は二重結合となり, ホルミル基 –CHO ができる.
環状でなければ単結合は回転できるので, –CHO の =O と –H はどちらを上に書いてもよい.
逆に, 環状の単結合は回転できないので, 鎖状構造の経由なしに直接 α⇄β の変形は起こらない.
さて, 単に「グルコース」というと鎖状構造のものを指すことに注意する.
電気陰性度 O > C より, 鎖状構造のホルミル基の C=O 間には大きな電荷の偏りがある.
また, OH 基の O は非共有電子対をもち, 正に帯電した部分と結合しようとする性質がある.
それゆえ, 鎖状構造のグルコースは, ホルミル基の C=O に OH 基が付加して閉環する.
一般に, アルデヒドやケトンの C=O にアルコールの OH 基が付加するとヘミアセタール構造が生じる.
C–O–C–O–C のように, 1つの C 原子が2つのエーテル結合をもつ有機化合物をアセタールという.
C–O–C–O–H のように, 一方の C が H になった部分をヘミアセタール構造という.
つまり, 1つの C 原子がエーテル結合 –O– と OH 基をあわせもつのがヘミアセタール構造である.
ヘミ (hemi) は半分を意味するギリシャ語である.
環状グルコースは, ヘミアセタール構造の部分が水溶液中で開環してホルミル基を生じる.
ホルミル基をもつ鎖状構造との平衡状態になるため, グルコース水溶液は還元性を示す.
フルクトースは, 果実に多く含まれるので果糖 (fruit sugar) とも呼ばれる.
天然の糖の中では最も甘く, スクロースよりもさらに甘い.
フルクトースは, 水溶液中では 5形態の平衡状態 となる.
割合が高い β(六員環), 鎖状, β(五員環) が重要で, 構造式を書けるようにしておく必要がある.
多くの教科書ではこの3形態だけが示されるが, 上級者は5形態を把握しておくべきである.
α形は β形の2位の C の上下を入れ替えただけである.
グルコースは6位の C の上につけたが,
β–フルクトースは一番右の C の下に CH₂OH をつける.
その結果, グルコースとは違って, この CH₂OH の C が 1位になる。
後は, 2位〜5位の C に 上上下下 の順で OH 基をつけると β–フルクトース(六員環)となる.
β(五員環)は, まず一番上が O, その他が C の五角形を書く.
次に, 右端の C の下と左端の C の上に CH₂OH をつける.
後は, 2位〜4位の C に 上上下 の順で OH 基をつけると β–フルクトース(五員環)となる.
環状フルクトースは, 環状グルコースと同様にヘミアセタール構造の部分で開環し, 鎖状構造となる.
2位の C の下が H ではなく CH₂OH なので, ホルミル基ではなく α–ヒドロキシケトンができる.
この構造は, 下のようにホルミル基をもつ構造との平衡状態をつくる (ケト–エノール互変異性).
ホルミル基
⇄ ⇄
ケト形 エノール形(不安定) ケト形
結果として, 鎖状構造中にホルミル基をもたないフルクトース水溶液も還元性を示す.
結局, 環状構造にヘミアセタール構造をもつかどうかが還元性の基準 である.
鎖状構造の α–ヒドロキシケトン 中の CO 基に 6位か 5位の C の OH 基が付加すると環状になる.
つまり, 六員環と五員環の違いは, 6位と5位のどちらの C の OH 基が付加するかの違いである.
【ガラクトース】
ガラクトースは, グルコースの 4 位の C の上下を入れ替えただけの単糖 である.
単糖類の性質
① 還元性あり.
フェーリング反応 単糖1 mol あたり 1 mol の Cu₂O(赤色)が生じる.
銀鏡反応 単糖1 mol あたり 2 mol の Ag が生じる.
② 親水性の OH 基を複数もつため, 水によく溶ける. 有機溶媒には溶けない.
③ 無色結晶で甘みがある.
甘さ比較 フルクトース > スクロース > グルコース
(単糖) (二糖) (単糖)
④ アルコール発酵
単糖は酵素群(チマーゼ)の作用で, エタノールと二酸化炭素 に分解される.
酒類の製造や, 工業的なエタノール生成で利用される.
C₆H₁₂O₆ →(チマーゼ)→ 2C₂H₅OH + 2CO₂
【還元反応と平衡の重要ポイント】
還元性を示すホルミル基をもつ鎖状構造の糖は, 水溶液中では少量しか存在しない.
しかし, その糖が酸化されて鎖状構造が減ると, 直ちにそれを補う方向に平衡が移る(ルシャトリエの原理).
十分量のフェーリング液やアンモニア性硝酸銀水溶液を加えると,
最終的にはすべての糖が酸化される。
よって, 生成した Cu₂O や Ag の質量から糖を定量できる.
糖 R–CHO(アルデヒド)は相手を還元するので, 自身は酸化されてカルボン酸 R–COO⁻ になる.
【反応例】
(酸化剤)
2Cu²⁺ + 2e⁻ + 2OH⁻ → Cu₂O↓ + H₂O ……①(フェーリング液)
(還元剤)
R–CHO + 3OH⁻ → R–COO⁻ + 2H₂O + 2e⁻ ……②
①+②
R–CHO + 2Cu²⁺ + 5OH⁻ → R–COO⁻ + Cu₂O↓ + 3H₂O
(酸化剤)
[Ag(NH₃)₂]⁺ + e⁻ → Ag↓ + 2NH₃ ……③(アンモニア性硝酸銀溶液)
③×2 + ②
R–CHO + 2[Ag(NH₃)₂]⁺ + 3OH⁻ → R–COO⁻ + 2Ag↓ + 4NH₃ + 2H₂O
✅ 単糖類の分類
炭素原子6個
ヘキソース(六炭糖)
例:グルコース, フルクトース, ガラクトース(すべて C₆H₁₂O₆)
炭素原子5個
ペントース(五炭糖)
例:リボース(C₅H₁₀O₅), デオキシリボース(C₅H₁₀O₄)
環を作る原子6個
ピラノース形(六員環構造)
例:α–フルクトース
環を作る原子5個
フラノース形(五員環構造)
例:β–フルクトース
鎖状構造がホルミル基をもつ
アルドース
例:グルコース, ガラクトース
鎖状構造がカルボニル基をもつ
ケトース
例:フルクトース
【補足】
ヘキソース・ペントースはギリシャ語の「6:ヘキサ」「5:ペンタ」に由来する.
リボースは RNA、デオキシリボースは DNA の構成要素で, 後に核酸で学習する.
同じ六炭糖でも六員環と五員環の両方が存在することがあり, 代表がフルクトースである.
ピラノースとフラノースはそれぞれピラン(左)、フラン(右)に由来する.
アルドースはアルデヒド, ケトースはケトンという語源をもつ.
単糖類の正確な立体構造
これまで、単糖の六員環構造を正六角形に近い形で表記してきた(ハース投影式).
正確には、六員環は平面ではなく、C の結合角が 109.5° となる いす型構造 をとっている.
このとき、置換基が垂直方向(縦線の結合)に同じ側へ多いほど立体反発が大きくなる.
グルコースは 2, 3, 4 位の C に OH がほぼ水平方向に結合しており、立体反発が小さい.
安定な立体構造ゆえ、C₆H₁₂O₆ の立体異性体の中でグルコースが天然に最も多く存在する.
さらに、1 位の OH も水平方向に結合した β が α よりも安定で、存在割合が高くなる.
【補足】
C の結合角は、正四面体構造をとる CH₄ の場合と同じ 109.5° となるときが最も安定する.
正六角形(平面)は内角が 120° なので不安定であり、3次元構造で安定化される.
舟型構造なども存在するが立体反発が大きく、ほとんどがいす型をとる.
単糖類の正体と異性体
下図中央のような 6 価アルコール(フィッシャー投影式による表記)について考える.
1 位の C に着目すると 第1級アルコール なので、この C の酸化で アルデヒド が生成する.
2 位の C に着目すると 第2級アルコール なので、この C の酸化で ケトン が生成する.
つまり、単糖類(鎖状構造)は 多価アルコールの酸化生成物 に他ならない.
そして、酸化される C の位置によってアルドースかケトースかが決まる.
下例の 6 価アルコールの酸化生成物がグルコースとフルクトースである.
鎖状グルコースは 4 個、鎖状フルクトースは 3 個 の不斉炭素原子をもつ.
よって、
鎖状グルコースは 2⁴ = 16 種、鎖状フルクトースは 2³ = 8 種の立体異性体 をもつ.
上図のような不斉炭素を中心とした立体配置を表現する表記法を フィッシャー投影式 という.
最も酸化度の高い官能基が一番上になるように主炭素鎖を縦に書く.
各不斉炭素原子の上下は紙面奥、左右は紙面手前に突き出る結合を表す.
構造式とは違い、結合の位置を変えると別の化合物になる。
以下のように、くさび形表記との対応で理解しやすくなる.
くさび形では、紙面手前に出る結合がくさび、奥に行く結合が波線で表される.
単糖類では、ハース投影式の下側の置換基がフィッシャー投影式の右側にくる 点が重要.
不斉炭素原子が複数ある場合、立体異性体は 鏡像異性体(エナンチオマー) と
ジアステレオマー に分類される.
中央図が教科書に載る鎖状グルコースのフィッシャー投影式.
鏡に映したように左右を反転すると、その 鏡像異性体(エナンチオマー) ができる.
これは すべての不斉炭素原子の左右が入れ替わる ことが本質である.
単糖(鎖状構造)の鏡像異性体は、CHO から最も遠い不斉炭素原子(グルコースは5位)につく
OH 基が右にくれば D 型、左なら L 型 と定義される.
なお、天然の単糖はほとんど D 型 である.
D–グルコースの 4 位の不斉炭素の左右を入れ替えると D–ガラクトース になる。
この2つは立体異性体だが鏡像ではないため、ジアステレオマー となる.
D–グルコースには 2⁴ = 16 種の立体異性体(D 型 8 種・L 型 8 種)が存在する.
つまり、D–グルコースと L–グルコースのような鏡像異性体ペアが 8 組ある.
鏡像関係にない立体異性体は全てジアステレオマーである.
5 個の不斉炭素原子をもつので、
環状グルコースは 2⁵ = 32 種の立体異性体 を持つ.
環状になると 1 位の C も不斉炭素となる(右回りと左回りで結合順序が異なる).
α–グルコースと β–グルコースは原子の結合順序は同じで構造異性体ではない。
OH 基の向きが異なる立体異性体で、鏡像ではないのでジアステレオマーである.
鏡像の α–L–グルコースを六員環が D 型と重なるように裏返すと右の構造が得られる.
このとき CH₂OH が 5 位の C の上側か下側かで D 型/L 型が決まる.
D 型の すべての不斉炭素原子の上下を入れ替えたもの が L 型となる.

