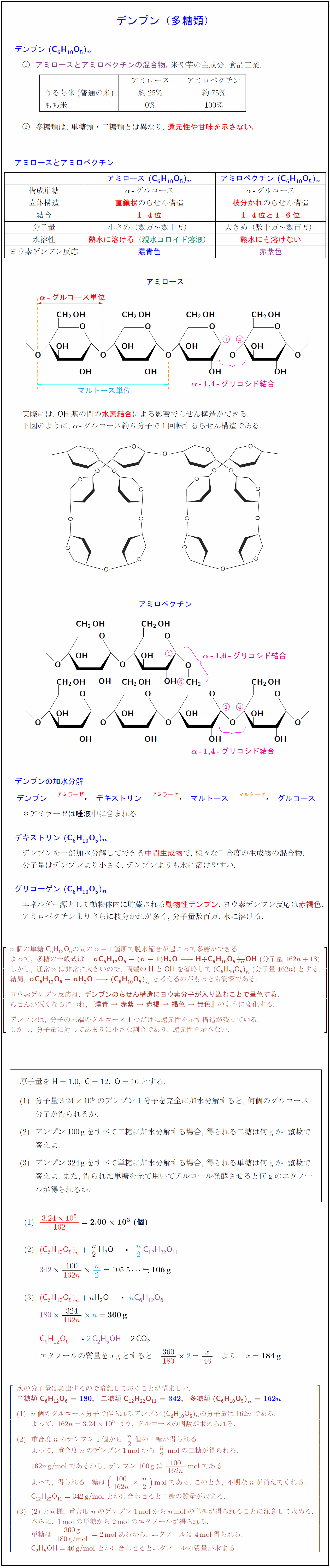
デンプンアミロースとアミロペクチンの混合物.\ 米や芋の主成分.\ 食品工業. & アミロース & アミロペクチン うるち米(普通の米) & 約25\% & 約75\% もち米 & 0\% & 100\% \ 多糖類は,\ 単糖類・二糖類とは異なり},\ 還元性や甘味を示さない. {アミロースとアミロペクチン{アミロース\ $(C₆H₁₀O₅})_n{アミロペクチン\ $(C₆H₁₀O₅})_n}$ 構成単糖 & $α$-グルコース & $α$-グルコース 立体構造 & 直鎖状のらせん構造 & 枝分かれのらせん構造 結合 & 1-4位 & 1-4位と1-6位 分子量 & 小さめ(数万~数十万) & 大きめ(数十万~数百万) 水溶性 & 熱水に溶ける(親水コロイド溶液) & 熱水にも溶けない ヨウ素デンプン反応 & 濃青色 & 赤紫色 {α}$-グルコース単位}{マルトース単位{${α}$-1,4-グリコシド結合 実際には,\ {OH}基の間の水素結合による影響でらせん構造ができる. 下図のように, $α$-グルコース約6分子で1回転するらせん構造である. {α}$-1,4-グリコシド結合{α}$-1,6-グリコシド結合デンプンの加水分解 ${デンプン}{->[アミラーゼ}]}デキストリン}{->[アミラーゼ}]}マルトース}{->[マルターゼ}]}グルコース$ *アミラーゼは唾液}中に含まれる. デキストリン\ $(C₆H₁₀O₅})_n}$ デンプンを一部加水分解してできる中間生成物で,\ 様々な重合度の生成物の混合物. 分子量はデンプンより小さく, デンプンよりも水に溶けやすい. グリコーゲン\ $(C₆H₁₀O₅})_n}$ エネルギー源として動物体内に貯蔵される動物性デンプン.\ ヨウ素デンプン反応は赤褐色. アミロペクチンよりさらに枝分かれが多く,\ 分子量数百万.\ 水に溶ける. $[l} n個の単糖{C₆H₁₂O₆}の間のn-1箇所で脱水縮合が起こって多糖ができる. \ よって,\ 多糖の一般式は {n{C₆H₁₂O₆}-(n-1){H₂O ->} {H -}-.7zw}({C₆H₁₀O₅})_{-1pt}{$n$}\ -1.7zw}{-}-{-}{OH\ (分子量\ 162n+18) しかし,\ 通常nは非常に大きいので,\ 両端の{H}と{OH}を省略して{(C₆H₁₀O₅)}_n\ (分子量162n)とする. 結局,\ {n{C₆H₁₂O₆} – nH₂O {->} {(C₆H₁₀O₅)}_n}\ と考えるのがもっとも簡潔である. ヨウ素デンプン反応は,\ {デンプンのらせん構造にヨウ素分子が入り込むことで呈色する.} らせんが短くなるにつれ,\ 『{濃青\ →\ 赤紫\ →\ 赤褐\ →\ 褐色\ →\ 無色}』のように変化する. デンプンは,\ 分子の末端のグルコース1つだけに還元性を示す構造が残っている. しかし,\ 分子量に対してあまりに小さな割合であり,\ 還元性を示さない. 原子量を${H}=1.0,\ {C}=12,\ {O}=16$とする. 分子量$3.2410⁵$のデンプン1分子を完全に加水分解すると,\ 何個のグルコース 分子が得られるか. デンプン100gをすべて二糖に加水分解する場合,\ 得られる二糖は何gか.\ 整数で 答えよ. デンプン324gをすべて単糖に加水分解する場合,\ 得られる単糖は何gか.\ 整数で 答えよ.\ また,\ 得られた単糖を全て用いてアルコール発酵させると何gのエタノー ルが得られるか. $エタノールの質量をx gとすると {360}{1802}={x}{46 より x={184 g} 次の分子量は頻出するので暗記しておくことが望ましい. {単糖類\ {C₆H₁₂O₆}=180},二糖類\ {C₁₂H₂₂O₁₁}=342},多糖類\ {(C₆H₁₀O₅)}_n=162n n個のグルコース分子で作られるデンプン({C₆H₁₀O₅})_nの分子量は162nである. よって,\ 162n=3.2410⁵\ より,\ グルコースの個数が求められる. 重合度nのデンプン1個から\ n2個の二糖が得られる. よって,\ 重合度nのデンプン1mol}から\ n2mol}の二糖が得られる. 162ng/mol}であるから,\ デンプン100g}は\ {100}{162n}\ mol}である. よって,\ 得られる二糖は({100}{162n} n2)mol}\ である.\ このとき,\ 不明なnが消えてくれる. {C₁₂H₂₂O₁₁}=342g/mol}\ とかけ合わせると二糖の質量が求まる. と同様,\ 重合度nのデンプン1mol}からnmol}の単糖が得られることに注意して求める. さらに,\ 1mol}の単糖から2mol}のエタノールが得られる. 単糖は\ {360 g}{180g/mol=2mol}あるから,\ エタノールは4mol}得られる. {C₂H₅OH}=46g/mol}\ とかけ合わせるとエタノールの質量が求まる.

